无氧酸的强度有何规律?如何解释?
时间:2019-11-15 08:46 来源:未知 作者:化学自习室 点击: 次 所属专题: 无氧酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
周期表上V A→VIA族元素的共价型氢化物在水或一些非水 溶剂中能够给出或结合质子而表现出酸碱性并有下述规律:
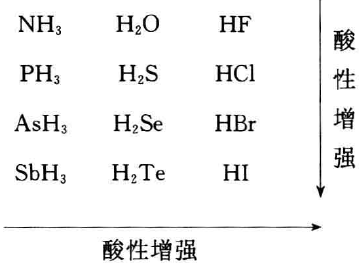
对此规律的解释大致有以下几种:
(1)从H—A键的键能和键极性大小解释 上述氢化物在水溶液中释出H+离子的难易程度与H—A之 间的键能以及这键的极性大小有关。在同一周期中,自左至右,如 NH3→H2O→HF系列中,HA的酸强度随元素A的电负性增加 (键的极性增加)而加强。在同一族中,从上到下,如在H2O→H2S→H2Se→H2TE系列中,键的极性虽然随A的电负性的递减而减小,但由于A的原子半径递增而使键能减弱的程度对酸强度的
影响超过了前者对酸强度的影响,所以HA的酸性增强。
(1) 用H—A分子中A原子电子密度大小解释
这种观点认为H—A中与质子直接相连的A原子的电子密度是决定无机酸强度的直接因素。A原子的电子密度越低,它对 质子的引力越弱,因而酸性也就越强,反之亦然。
同一周期的氢化物中如NH3→H2O→HF系列,由于直接同 质子相连原子的氧化数逐渐降低(因而所带的负电荷也依次减 少),从而使这些原子的电子密度越来越小,所以相应的氢化物酸 性依次增强。在同一族的氢化物中,同氢结合的a原子所带的电 荷相同,但它们的原子体积随着原子序数的增大而增大,使这些 原子的电子密度逐渐变小,因而其相应的氢化物的酸性依次增强, 如 HF<HCl<HBr<HI。同理,H2O<H2S<H2Se<H2Te。
这种观点克服了用键能只能说明同族氢的酸强度变化规律, 用电负性(键的极性)只能说明同周期氢酸强度变化规律的矛盾, 使同一周期和同一族中氢化物酸强度变化的规律得到了统一的 解释。
(2) 用热力学方法加以解释
H—A的酸性强度是由HA的水合能、HA的解离能、H原子电离能、A的电子亲合能、A-的水合能等多种因素决定的。通过 热力学分析得出:
同一主族(如HF—HI)随着原子序数增大HA键能依次降 低,对酸强度变化起主导作用,虽然电子亲合能、水合能也依次降低,但只起次要作用。
对于同一周期,则是水合能与电子亲合能占主导地位。例如 H2O→HF,虽然HF的键能比H2O大,但由于F-的水合能和F的 电子亲合能两者放出能量多,所以HF电离时放出能量比H2O的 多,其电离趋势比H2O大,相应H2O与NH3比也是如此,即NH3→H2O→HF酸强度依次增大。

- 全部评论(0)
