元素周期律中的特例之原子半径解读
时间:2020-02-15 13:42 来源:未知 作者:淮畔化学 点击:次 所属专题: 半径比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

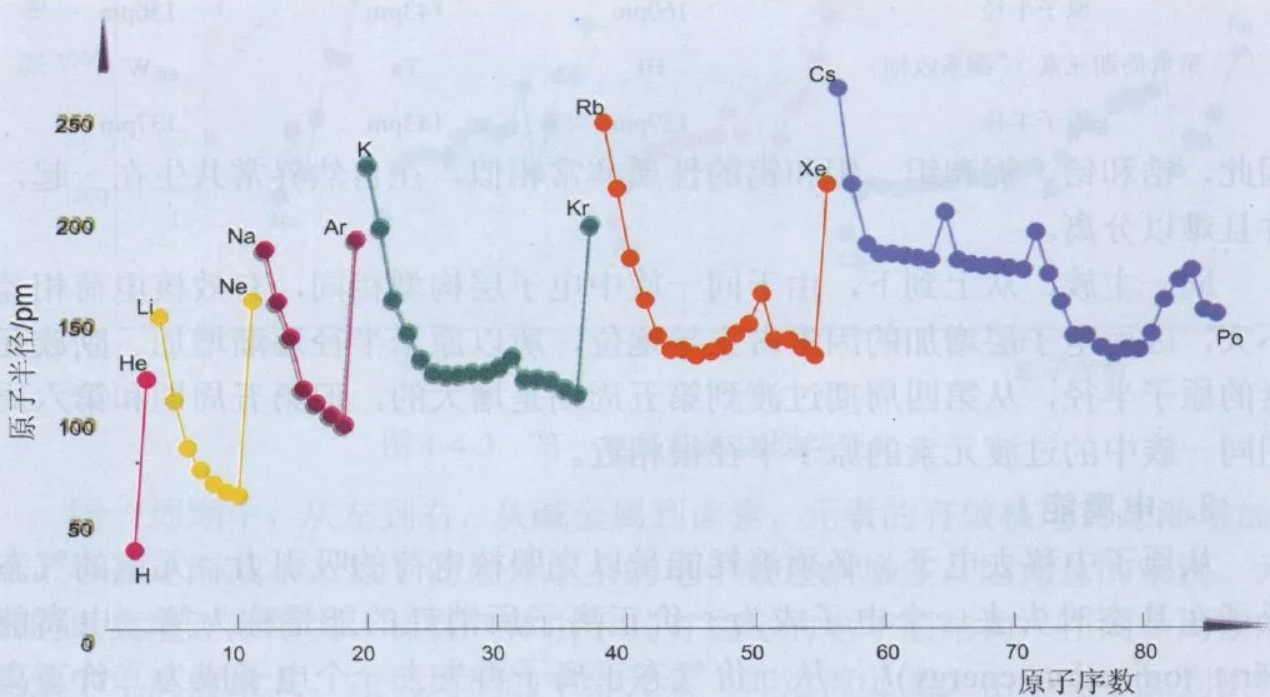

原子半径的大小主要取决于原子的有效核电荷和核外电子层数。
对于多电子原子,核外的一个电子不仅仅受到原子核的吸引,而且还受到其余电子的排斥作用,必定会抵消原子核对该电子的吸引,此电子实际受到的核电荷比原子序数(Z)小。电子实际受到的核电荷称为有效核电荷,用Z*表示,Z*=Z-σ。其中,Z为核电荷数,σ为屏蔽常数,通常近似于非价电子数,可用斯莱特法则近似计算。

有效核电荷Z*的周期性变化
1、同一周期,电子填充在同层轨道上,同层电子彼此屏蔽较小,核电核数依次增加,有效核电荷Z*依次增大,原子半径依次递减。
2、同一族,从上到下,Z*增加,但不显著。
3、同一周期,递减幅度:主族元素>d区过渡元素>长周期内过渡元素

主族元素,原子半径减小比较明显
因为电子依次填入最外层ns,np轨道,同层电子相互屏蔽作用小(0.35),以致作用于最外层电子的有效核电荷增幅显著。
d区过渡元素,原子半径减少的幅度要小
因为电子依次填入次外层(n-1)d轨道,对最外层ns电子的屏蔽较大(0.85),故有核电荷增幅较少。
长周期内过渡元素,原子半径减小幅度更小
因为在长周期内的过渡元素,特别是镧系元素,电子依次填入(n-2)f轨道,对最外层电子的屏蔽更大,以致有效核电荷增加更少,半径收缩也就极小。
特殊一:

原因:d或f区元素电子屏蔽大,有效核电荷增加少,半径收缩小;ds区元素,最外电子层全充满或半充满,电子云球形对称,电子排斥作用增加,半径增大。
特殊二:镧系收缩
镧系元素从左往右,原子半径减小幅度更小,这是由于新增加的电子填入外数第三层上,对外层电子的屏蔽效应更大,外层电子所收到的Z*增加的影响更小。镧系元素从镧到镱整个系列的原子半径减小不明显的现象称为镧系收缩。

d区第六周期(如Hf、Ta)与第五周期同族元素(如Zr、Nb)半径接近,几乎没有增加。(镧系收缩)。
特殊三:钪系收缩
在p区第四周期的镓(Ga)和第三周期的(Al)相比,半径没有相应的增大。这是因为Ga以前,刚刚经过了d区和ds区(n-1)分层有了电子,出现了类似镧系收缩的效应,使紧挨着的镓的半径受到影响,我们称之为“钪系收缩”。

原因:在p区第四周期的镓(Ga)和第三周期的(Al)相比,半径没有相应的增大。这是因为Ga以前,刚刚经过了d区和ds区(n-1)分层有了电子,出现了类似镧系收缩的效应,使紧挨着的镓的半径受到影响,我们称之为“钪系收缩”。

- 全部评论(0)
(1375102700) 评论 元素周期律中的特例之原子:很有用!很清晰!
