电离度的概念和应用
时间:2019-11-15 22:46 来源:未知 作者:化学自习室 点击: 次 所属专题: 电离度
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(1) 电离度(α)
①电离度定义式:弱电解质在水溶液中达成电离平衡时
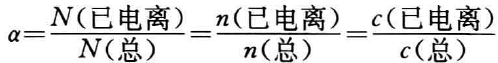
N、n、C分别代表电解质的分子个数、物质的量和物质的量浓度。
(2) 影响电离度的外因
①温度。弱电解质的电离多为吸热过程(少数例外,如HF、 H2SO3、H3PO4电离放热),升高温度,电离度增大。
②浓度。随着溶液稀释,电离度增大,无限稀释,电离度趋 于100% (可见为α=100%—定是强电解质的说法是错误的)。
电离度的增减和溶液里离子浓度的增减不一定一致。当溶液较浓时,随着溶液的稀释,电离度增大倍数大于溶液浓度降低倍 数,离子浓度增大;当溶液较稀时,随着溶液的稀释,电离度增 大的倍数小于溶液浓度降低的倍数,离子浓度下降。对于一元弱 酸(碱)的稀溶液,在α<5%时,[H+](或[OH-]) =(K为电离平衡常数,c为弱酸或弱碱的起始浓度)。
③同离子效应。在弱电解的电离平衡体系中,加入含有相同 离子的强电解质会降低弱电解质电离度与另一离子浓度。
(3)电离度的应用
①在同温、同浓度条件下,判断弱电解质的强弱。
②进行有关计算,α表达式中知二求一。
[例2 - 10] 根据下表数据,比较相同温度下,下列三种酸 的相对强弱,正确的是______ 。
酸 | HX | HY | HZ | ||
浓度 C/mol • L-1 | 0.1 | 0. 5 | 0. 9 | 1 | 1 |
a/% | 0. 3 | 0.15 | 0. 1 | 0. 3 | 10 |
A. HX>HY>HZ
B. HZ>HX>HY
C. HY>HZ>HX
D. HZ>HY>HX
[解析]同温、同浓度下,α越大,电解质越强,故酸的强 度为HZ>HY;HY与HX浓度不同,不能由电离度直接判断二者 相对强弱,当HY浓度由1稀释为0. 1时,HY电离度将增大 >0. 3),故酸的强度HY>HX。所以酸的强度为HZ>HY>HX。 答案为D。
[例2 - 11] 在一定浓度下,冰醋酸加水稀释过程中,溶液 的导电能力I随加入水的体积V变化的曲线如图2 - 4所示。请回答:
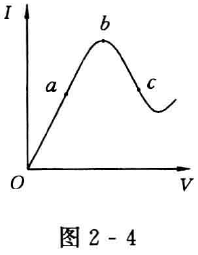
①“O”点导电能力为0的理由是:
②a、b、c三点[H+]由大到小的顺序为:
③a、b、c三点中电离度最大的是:
④若使c点溶液中[Ac-]增大,[H+]减小,可采取的措施是___________ ,_________ ,_________ ;
⑤取等体积与b点导电性相同的盐酸,稀释到与c点相同体积时,电流强度与c相比_________ c。(填“大于”、“小于”或“等于,,)
[解析]①溶液导电性强弱取决于溶液中[H+]、[Ac-]的 大小,“O”点是无水醋酸,共价型电解质无水不电离,各离子浓 度为0,所以I为0;②导电性b>a>c,所以[H+]也是b>a> c;③随着溶液稀释,α增大,c点稀释度最大,所以α最大;④ 欲使c点[Ac-]增大,[H+]下降,必须在溶液体积不变的情况 下,使HAc电离平衡向右移动,可采取措施为加NaOH晶体或加 入Na2CO3晶体或加入锌、镁等活泼金属;⑤与b点导电性相同的 盐酸[H+]与HAc溶液相同,稀释相同倍数[H+]下降的比HAc 溶液多,所以I小于c。

- 全部评论(0)
