什么是第一电子亲和能?
时间:2025-10-11 10:29 来源:未知 作者:化学自习室 点击: 次 所属专题: 电子亲和能
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

【导读】与第一电离能定义相反(并非严格互逆过程),第一电子亲和能是指基态的气态原子(或离子)获得一个电子形成气态阴离子时所放出或吸收的能量,通常用符号Eₐ表示,单位kJ/mol,它反映出原子(或离子)获取电子的能力。
简单理解:第一电子亲和能衡量的是一个气态原子“渴望”获得一个电子的程度。释放的能量越多,Eₐ₁负值越大,说明原子抓取电子的能力越强,生成的阴离子也越稳定。

一:什么是第一电子亲和能?
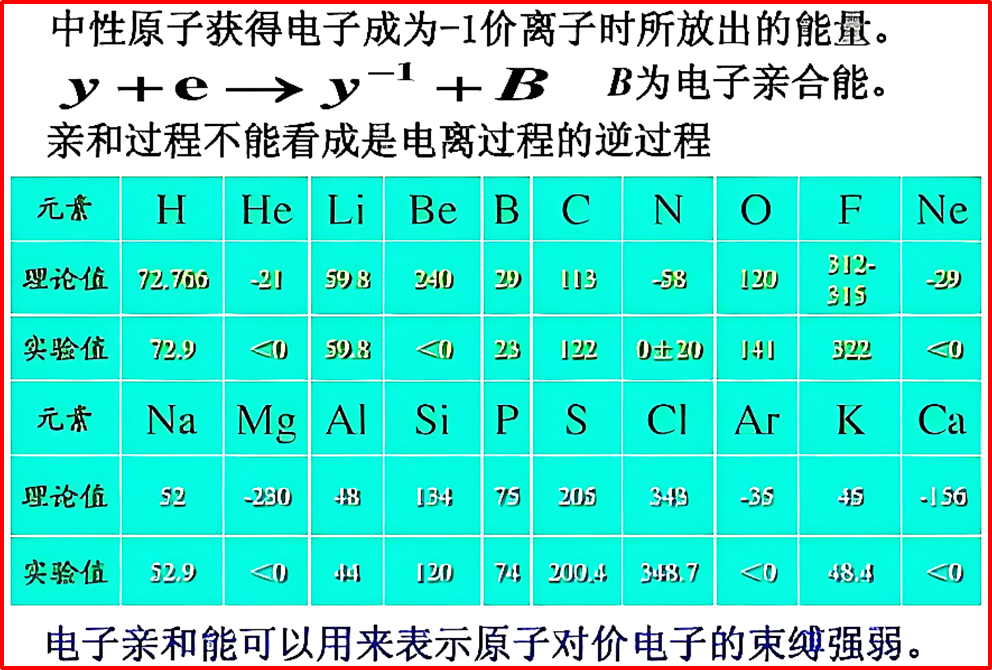
第一电子亲和能:在标准状态下,1mol气态基态原子获得1个电子,形成1mol气态-1价阴离子时所伴随的能量变化。
X(g)+e⁻→X⁻(g)+Eₐ₁
如果这个过程释放能量(放热),则Eₐ₁为负值(-),所得产物能量比反应物低,体系更稳定。
如果这个过程吸收能量(吸热),则Eₐ₁为正值(+),这就意味着得到的阴离子不稳定。

二:第一电子亲和能的大小与哪些因素有关系?
1.原子半径:最主要的因素
原子半径越小,核外电子层离核越近,原子核对外来电子的有效吸引就越强。获得电子时释放的能量就越多,Eₐ₁负值越大。
如氯原子(Cl)的半径小于碘原子(I),所以氯的电子亲和能-349kJ/mol比碘-295kJ/mol更负,意味着氯更容易得电子。
2.有效核电荷
有效核电荷越大,原子核对外来电子的吸引力就越强。这同样会使得到电子后释放的能量增多,Eₐ₁负值越大。
如在同周期中,从左到右,有效核电荷显著增加,所以电子亲和能的绝对值总体趋势是增大的。
3.电子构型(稳定性):导致“例外”和“反常”的关键因素
如果得到一个电子后,能达到全满或半满的稳定电子构型,那么这个过程会释放更多能量,Eₐ₁更负。反之,如果原子本身已经是全满(如稀有气体)或半满的稳定结构,再加一个电子反而会破坏这种稳定性,需要吸收能量,Eₐ₁为正值。
如氧和硫:氧原子的电子亲和能-141kJ/mol不如硫-200 kJ/mol负。这是因为氧原子太小,电子云密度已经很高,新加入的电子会受到原有电子强烈的排斥作用,部分抵消了原子核的吸引,导致净释放的能量减少。
再如氮原子:氮的电子亲和能是很小的正值+7kJ/mol,因为它的电子构型是2s²2p³,这种半满结构已经比较稳定了,得到一个电子反而会破坏这种稳定性。
三:在元素周期表中第一电子亲和能有哪些趋势规律?
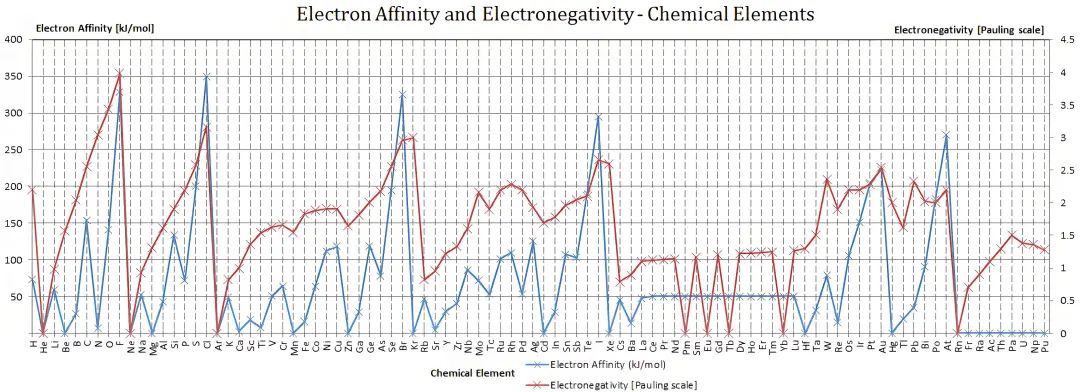
在元素周期表中,第一电子亲和能呈现明显的周期性规律。
同周期的规律性:从左到右电子亲和能的绝对值增大,即Eₐ₁值变得更负,原子得电子能力增强。同周期元素从左到右电子层数不变,原子半径递减,同时有效核电荷递增,共同导致原子核捕获电子的能力增强。
同主族的规律性:从上到下电子亲和能的绝对值减小,即Eₐ₁负值变小,原子得电子能力减弱。同主族元素从上到下,电子层数增加,原子半径增大成为主导因素。核对外来电子的吸引力减弱,得电子后释放的能量减少。

四:在元素周期表中第一电子亲和能有哪些例外情况?
1.同周期重要例外简析
ⅡA族(碱土金属,如Be、Mg):ns²全满结构,相对稳定,得电子倾向弱,其Eₐ₁为正或很小的负值。
ⅤA族(如N、P):np³半满结构,非常稳定,得电子倾向减弱。同样氮的Eₐ₁为正值,并且磷的Eₐ₁-72kJ/mol也比相邻的硫-200kJ/mol和硅-134kJ/mol小得多。
稀有气体(0族,如Ne、Ar):具有最稳定的ns²np⁶八电子结构,得电子需要吸收大量能量,Eₐ₁为正值。
2.同主族重要例外简析
第二周期与第三周期对比:第二周期元素(如F,O)的Eₐ₁绝对值反而小于其下方第三周期的同族元素(如Cl,S)。
氟和氧原子半径太小,电子云密度太高,当加入一个新电子时,会受到电子云中已有电子非常强烈的排斥,这种排斥力部分抵消了原子核的吸引力,导致净释放的能量反而没有氯和硫多。


- 全部评论(0)
