溶解度与溶度积常数的关系
时间:2025-11-05 10:55 来源:未知 作者:化学自习室 点击: 次 所属专题: 溶度积 溶解度
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切相关,但二者概念不同、单位不同、适用范围不同。它们之间的关系可以通过沉淀-溶解平衡建立,并在理想稀溶液、无副反应的假设下进行定量换算。下面结合具体实例详细说明。
一、基本概念
项目 | 溶解度(S) | 溶度积常数(ksp) |
|---|---|---|
定义 | 在一定温度下,某固态物质在1 L溶液中达到饱和时所溶解的物质的量(通常以 mol/L 表示) | 难溶电解质在饱和溶液中各离子浓度幂的乘积(严格应为活度,但常以浓度近似) |
单位 | mol/L(或 g/L) | 无单位(严格说是有单位的,但常省略) |
性质 | 是一个实验可测的物理量,受温度、pH、共存离子等影响 | 是一个热力学常数,仅与温度有关(理想条件下) |
二、核心关系:通过溶解平衡建立联系
假设一种难溶电解质 AmBn在水中溶解并完全电离:

设其摩尔溶解度为Smol/L),即每升溶液中溶解了 S摩尔的 AmBn
根据化学计量关系:

代入溶度积表达式:
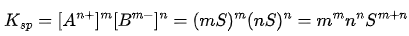
由此可解出溶解度:
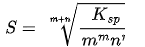
重要前提:
1. 溶液为理想稀溶液(活度 ≈ 浓度);
2. 无水解、络合、氧化还原等副反应;
3. 固体为纯相、化学计量比明确。
三、结合实例说明
实例1:AB 型(1:1)——氯化银(AgCl)
溶解平衡:

设溶解度为 Smol/L,则:

溶度积:
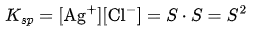
已知 (25°C),则:
(25°C),则:

换算为质量溶解度:
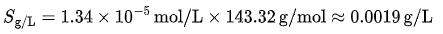
结论:AgCl 极难溶,计算与实验值吻合较好(因无显著副反应)。
实例2:AB₂ 型(1:2)——氟化钙(CaF₂)
溶解平衡:

设溶解度为S mol/L,则:

溶度积:
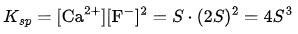
已知  则:
则:

注意:若错误假设 ,会得
,会得 导致
导致  误差达30多倍!
误差达30多倍!
实例3:存在副反应——氢氧化铁(Fe(OH)₃)
表面平衡:

若按理想情况计算溶解度(pH=7,[OH⁻]=10⁻⁷ M):
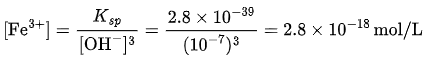
但实际情况,Fe³⁺ 在水中强烈水解:
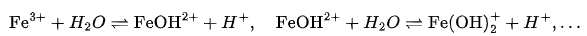
总溶解铁浓度 = [Fe³⁺] + [FeOH²⁺] + [Fe(OH)₂⁺] + [Fe(OH)₄⁻] + …
在 pH=7 时,实际总溶解度比 2.8×10⁻¹⁸ mol/L 高出数个数量级!
结论:对易水解、络合的离子(如 Al³⁺、Fe³⁺、CO₃²⁻、S²⁻等),不能直接用ksp 计算总溶解度,必须考虑副反应。
四、总结:关系与局限
1.简单难溶盐(如 AgCl、BaSO₄)在纯水中 可以 离子浓度低,无副反应,误差小
2.非1:1型盐(如 CaF₂、Ag₂CrO₄) 可以(但需正确设浓度) 必须按化学计量比设定离子浓度
3.含水解/络合离子的盐(如 Fe(OH)₃、CaCO₃、AgCl in NH₃) 不能 总溶解度远高于ksp 预测值
4.有共同离子存在(如 AgCl in NaCl) 部分可以 需用  ,但 [Cl⁻] ≈ [Cl⁻]₀
,但 [Cl⁻] ≈ [Cl⁻]₀
核心要点:
ksp描述的是饱和溶液中“自由离子”的平衡浓度积,而溶解度描述的是“总溶解物质的量”。
1.二者仅在无副反应、理想稀溶液条件下可通过化学计量关系直接换算。
2.一旦体系复杂(pH变化、配体存在、高离子强度),必须引入副反应系数(α)或活度修正,否则计算结果将严重失真。

- 全部评论(0)
