配合物或晶体中配位数概念与判断
时间:2020-01-02 09:59 来源:未知 作者:化学自习室 点击:次 所属专题: 配位数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、配位数的概念
配位数是由化合价分化产生的另一个概念,它主要用于晶体和配合物。
1. 晶体学中的配位数在晶体中,原子或离子总是按一定方式与周围的原子或离子相结合,此时,一个质点与周围直接接触的质点数称为配位数。原子配位数是指某一个原子周围所接触到的同种原子的数目;离子配位数是在离子晶体中,每个离子周围所接触到的异性离子的个数。在金属晶体中,由于金属原子通常做最紧密堆积,决定了金属原子具有较高或最高的配位数。
2. 配位化学中的配位数配位化合物(简称配合物)的配位数是直接同中心原子(离子)合的配位原子数目,即中心原子(配离子)接受孤对电子或形成配位键的数目。
二、配位数与物质结构
1. 晶体中配位数晶体中原子(离子)的配位数与晶体结构或晶胞类型有关。

(1)原子晶体由于共价键有方向性和饱和性,所以原子的配位数决定于元素的共价。例如石英(SiO2)晶体是原子晶体,其中每个硅原子和4个氧原子以共价键相连结,每个氧原子和2个硅原子相连结,因此硅和氧原子的配位数分别为4和2,与它们的共价数分别相等。
(2)离子晶体形成离子键的正、离子的电子云分布,通常是球形对称的,所以离子键没有方向性和饱和性。正、负离子交错排列,跟尽可能多的异号离子接触,因此配位数比较高。
如NaCl的晶胞,观察晶胞类型:看空心圆点,正六面体的八个顶点及六个面的面心各有一个,所以为面心立方晶系。以顶点上的原子分析,该顶点的上下、左右、前后各有1个最近的异号离子,或以体心的离子分析,与体心最近的异号离子为六个面心的的离子,故钠(或氯)离子的配位数为6。
再看CsCl的晶胞,看空心圆点,除了立方体的顶点的8个,无其它,称为简单立方晶胞,与体心(或顶点)离子距离最近的异号离子有8个,故铯(或氯)离子的配位数为8。
(3)金属晶体
金属单质晶体中的配位数与金属阳离子的堆方式有关。
名称 | 立方密堆积 (立方面心堆积) | 立方体心堆积 | 立方密堆积 |
符号 | A1 | A2 | A3 |
配位数 | 12 | 8 | 12 |
金属阳离子以立方体心堆积(A2型密堆积)而成的晶体配位数从晶胞结构图较容易看出。这里主要分析大多数金属阳离子的紧密堆积的形式。
金属阳离子在一层中,最紧密的堆积方式是一个球与周围6个球相切,在中心的周围形成6个凹位,将其算为第一层。第二层对第一层来讲最紧密的堆积方式是将球对准1、3、5位(若对准2、4、6位,其情形是一样的)。
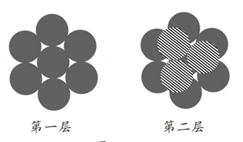
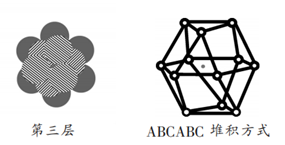
关键是第三层,对第一、二层来说,可以有两种最紧密的堆积方式。第一种是将球对准第一层的球于是每两层形成一个周期,即ABAB堆方式,形成六方紧密堆积(A3型密堆积),配位数12(同层6,上下各3)。

另一种是将球对准第一层的2、4、6位,不同于AB两层的位置,这是C层。第四层再排A,于是形成ABCABC 三层一个周期。得到面心立方堆积(Al型密堆积),配位数12。
2. 配合物中的配位数
(1)根据中心原子核外电子排布的情况判断
①对于电子构型为d0、d5、d10的中心离子,多数形成配位数为4的配合物,如FeCl4-、HgI42-、MnO4-。
②对于电子构型为d8的中心离子,与强场配体易形成配位数为4的配合物,而在其它弱场配体的作用下,可形成配位数为6的配合物,如Ni2+与CN-形成[Ni(CN)4]2-,与NH3形成[Ni(NH3)6]2+。
③对于电子构型为d3和d6的中心离子,多形成配位数为6的化合物,如[CO(CN)6]3-和[Cr(NH3)6]3+
④电子构型为d7的中心离子,与强场配体易形成配位数为6的配合物,与弱场配体易形成配位数为4的配合物,如Co2+与CN-形成[Co(CN)6]2-,与SCN-形成[Co(SCN)6]2-。
根据以上经验规则我们来确定CuSO4·5H2O中Cu2+的配位数,Cu2+的价电子构型为d8,水为弱场配体,故配位数为4。因为水的配位能力强于SO42-,所以4个水分子Cu配位形成水合铜离子[Cu(H2O)4]2+,每个离子还可与一个水分子形成氢键。所以硫酸铜晶体的化学式可写为[Cu(H2O)4]SO4·H2O。
(2)根据配位数的定义判断在计算中心原(离)子的配位数时,一般是先在配合物中确定中心原(离)子和配位体,接着找出配位原子的数目。
如果配位体是单配体(即每个配体只提供一个配位原子),配位体的数目就是该中心离子的配位数。例如,[Pt(NH3)4]Cl2和[Pt(NH3)2Cl2]中的中心离子都是Pt2+,而配位体前者是NH3,后者是NH3和Cl-,这些配位体都是单齿的,因此它们的配位数都是4。如果配位体是多齿(即每个配体只提供多个配位原子),那么配位体的数目=每个配位体中的配位原子数×配位体数。如[Cu(en)2]2+中的乙二胺(en)是双配体,即每1个en有2个N原子与中心离子Cu2+配位,在此,Cu2+的配位数是4而不是2。
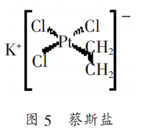
根据配合物中配位数的定义确定经典配合物的配位数是十分成功的,但它也存在着一定的局限性。如用配位数的定义分析新型的特殊配合物蔡斯盐K[(CH2=CH2)PtCl3],在内界中与Pt相键合的配体有4个而与之相键合的原(离)子却是5,2个C原子,三个Cl-。那么Pt的配位数应该是多少呢?
(3)根据18电子规则判断非经典配合物的配位数
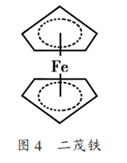
18电子规则又称有效原子序数法则(EAN),是过渡金属簇合物化学中比重要的一个概念,同p区元素的8隅律一样,是同样有其量子化学来源的。过渡金属价电子层有5个nd、1个(n+1)s和3个(n+1)p轨道,共可容纳2×9=18个电子。如果18个电子(非键或成键电子)填满了其价电子层,使其具有与同周期稀有气体原子相同的电子结构,即金属的原(离)子的电子总数与所有配体提供的电子数之和等于同同期稀有气体的原子序数,则该配合物是稳定的。此时有:2×配位数中心原(离)价电子数=18。如二茂铁Fe(C5H5)2{C5H5表示环戊二烯环离子},结构如图。二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。
因此每个环含有6个π电子,每个环的6个电子×2,再加上二价铁离子的6个d电子正好等于18,符合18电子规则,因此二茂铁中铁的配位数为6。
有些时候,它不是18而是16。这是因为18e-意味着全部s、p、d价轨道都被利用,当金属外面电子过多,意味着负电荷累积,此时假定能以反馈键M→L形式将电荷转移至配体,则18e-结构配合物稳定性较强;如果配体生成反馈键的能力弱,不能从金属原子上移去很多的电子云密度时,则形成16电子结构配合物。因此,EAN规则在有些书上直接叫18e-和16e-规则。如前面提到的蔡斯盐K[(CH2=CH2)PtCl3]中Pt的价电子构型为d8,3个Cl-提供三个孤电子对,乙烯的提供一个π电子对,成键电子总数为8+4×2=16.则有2×配位数+中心原(离)价电子数=16,所以蔡斯盐中Pt的配位数为4,其中1个C2H4、3个Cl为配体。
根据18电子规则可以确定金属羰基配合物的配位数,例如Ni的原子序数为28,每个CO提供2个电子配位,同周期稀有气体的原子序数为36,所以每个Ni与4个CO配位形成Ni(CO)4
分析特殊配合物的配位数,发现配合物中配位数的定义不用于原子晶体离子晶体及有机基团中配位数的确定,有必要赋予配位数一个全面的定义。通过对晶体、各类配合物的结构和成键情况的考察,个人认为配位数就是在化学结构中,与某一元素的原子(离子)相键合的原子(离子)的数目或“提供的电子对的数目”。此概念也可延伸至任何化合物,也就是配位数等同于共价键键连数。例如,可以说几万中碳的配位数为4.这种说法通常不计π键。所以考虑到分子的共轭,认为酞菁铜分子中Cu2+的的配位原子是4个N原子(具有孤对电子的两个N原子和H解离后留下孤对电子的两个N原子)更合理。
综上所述,配位数的判断是一个复杂的问题,不仅要理清配位数的概念,还要考虑物质的空间结构及其原子间的键合。

- 全部评论(0)
