如何学好原电池中的双液电池兼谈盐桥的作用
时间:2020-12-22 09:24 来源:未知 作者:化学自习室 点击: 次 所属专题: 盐桥 双液电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在电化学中,原电池中的单液电池构造比较简单,如下图所示:

其原理是:相对活泼的一极发生失去电子的氧化反应(Zn - 2e-=Zn2+),是原电池的负极;相对不活泼的一极发生还原反应(2H++ 2e-=H2↑),是原电池的正极。
这个氧化反应是电解质溶液中的某种微粒发生的,电极本身没有发生反应。
总的反应是:Zn+2H+= Zn2++H2↑
上面的原电池,随着时间的推移,电流计的示数会越来越小,说明这样的原电池并不能持续供电。那究竟是什么原因,造成电子转移不能持续呢?
这个原因就是电极的极化。
造成极化的主要原因是,金属锌失去电子的速率和金属锌变成离子进入溶液的离子化过程不等,氢离子获得电子的速率和氢离子变成氢分子的速率不等,也就是说离子化过程和氧化还原的过程速率不等。一般说来,氧化还原反应的速率会比离子化的过程快一些。随着时间推移,就使得金属锌表面富集大量的锌离子,而锌离子带正电,就会吸引和束缚电子而使得锌失去电子的反应越来越困难。
以上,是对电极极化的一个通俗的解释,并不是完美的科学解释。只是给高中学生一个逻辑上的认识。
我们学习知识,经常遇到这样的现象。一个是问题原本什么样?对于这个问题来说,原本的本真由于高中学生的知识基础,是无论如何也理解不了的。二是问题能解释到什么程度?对于上面的问题,就是高中生可以接受的程度了。这两点,包括化学教师,在教学中都应该注意。
既然上面的装置不能持续地提供电能,那经过怎样的设计可以实现原电池供电的高效率呢?以下就是双液电池的装置:
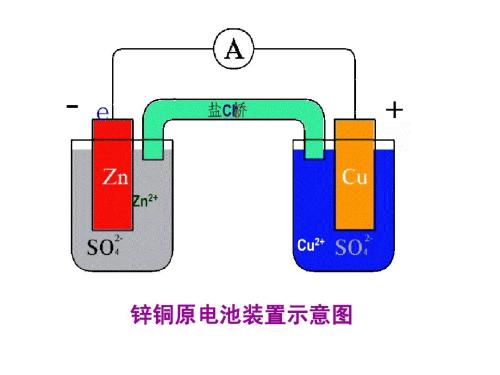
以上的装置,可以观察到的现象是:铜电极上有红色的铜不断地析出,电流计指针发生持续的偏转。
由于电流计指针偏转,说明有电流产生。产生电流的原因,一定是电子的定向移动。由于锌的活泼性比铜强,所以锌失去电子为原电池的负极,电极反应式为:Zn - 2e-= Zn2+
铜一极为正极,能的电子的粒子有两种,一种是氢离子,一种是铜离子。由于氧化性铜离子强,所以发生的电极反应为:Cu2++ 2e-= Cu.
总的原电池反应为:Zn+Cu2+= Zn2++Cu
同学们可能注意到,上面的装置中,有一个C装置,叫做盐桥。
盐桥是一个U型管填充有含琼脂胶的KCl饱和溶液的装置。那么,盐桥究竟起什么作用呢?
对于上面的装置,当原电池的负极发生反应时,左侧的烧杯中,就会有大量的带正电的锌离子产生,这时盐桥中的带负电的氯离子就会移动过来,从而消除电极的极化使得溶液保持电中性。同理,原电池的正极发生反应时,溶液中的铜离子放电后,就使得溶液中的负电荷过剩,此时带正电的钾离子就会移动过来,维持溶液的电中性,从而也消除了电极的极化。
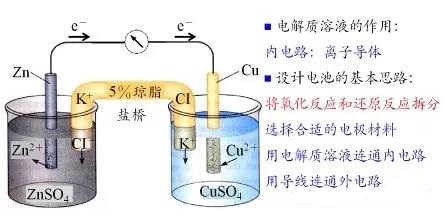
小结一下,双液电池中的盐桥,其作用是维持溶液的电中性,消除电极的极化,从而使原电池反应得以持续,提高原电池的供电效率。
所以,科学的进步总是建立在已有的事实之上的。単液电池的缺陷,经过改进就有了双液电池,而解决问题的核心就是采用了盐桥。
盐桥的使用突破了氧化剂、还原剂只有直接接触、相互作用才能发生电子转移的思维定式,能使氧化反应与还原反应在不同的区域之间进行得以实现。为原电池持续、稳定地产生电流创造了必要的条件,也为原电池原理的实用性开发奠定了理论基础。

- 全部评论(0)
