盐桥到底有何作用?
时间:2022-03-10 16:33 来源:未知 作者:化学自习室 点击: 次 所属专题: 盐桥
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

▲Zn-Cu galvanic cell
想了解盐桥究竟有什么作用?不妨先把盐桥除去,看会发生什么?
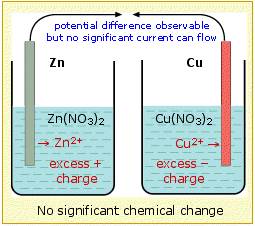
▲galvanic cell without salt bridge
从原理上分析,没有盐桥的原电池是可以产生电流的。但是很快就没有了。
究其原因是外电路仍然可以发生短时、微量的电子转移。但为什么没过多久电流又消失了?
有的人不假思索的肯定就说没有形成回路。
其实还有一层原因:
当没有盐桥时,左边的半电池会积累Zn2+,右边的半电池会积累NO3- ,这样一来就会导致两边电解质溶液中电荷不守恒,会阻止反应进一步进行,这就是外电路仍然可以发生短时、微量的电子转移。但为什么没过多久电流又消失了的原因。
为了维持电池继续反应,这意味着我们必须为过量的离子提供一条转移路径。也就是原电池左室中的释放产生的正电荷可以通过这些转移到原电池右室,或者NO3-从右室扩散到左边。
要想实现这样的构想,科学家设计出如下原电池图示。
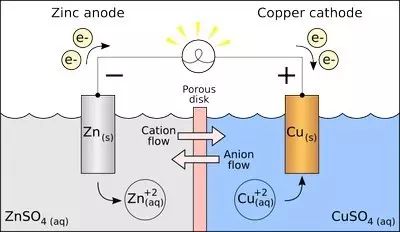
▲原电池左右两室中间是多孔玻璃(隔膜),只允许离子通过
▲将两个烧杯通过多孔玻璃(隔膜)熔结起来
如此一来,就解决了原电池两室某种离子积累的问题。
说到这里好像没盐桥什么事。其实上述两种装置还是存在一个很大的问题。
这个问题就是电化学中讲到的液接电势。
液接电势是什么?又是怎么产生的呢?一张图告诉你答案。
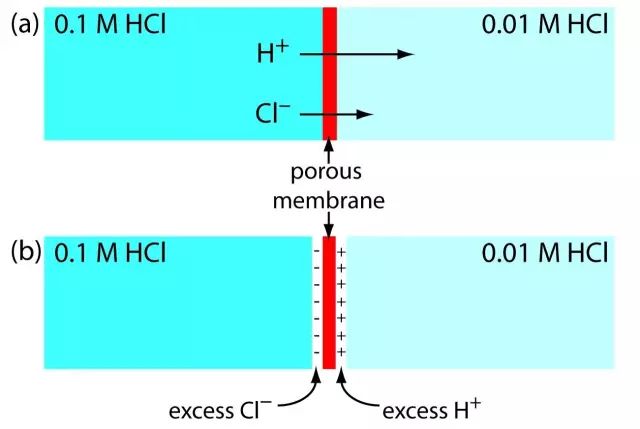
▲0.1M和0.01M盐酸溶液间液接电势(liquid junction potential)的来源
因为膜左侧的盐酸浓度大于膜右侧的浓度,所以H+和Cl-会在箭头方向扩散。但是,H+的迁移率大于Cl-的迁移率(如各自箭头的长度差异所示)。由于迁移率的差异,膜右侧的溶液具有过量的H+和正电荷(如图所示)。而膜左侧溶液会产生负电荷,这样就产生了液接电势。
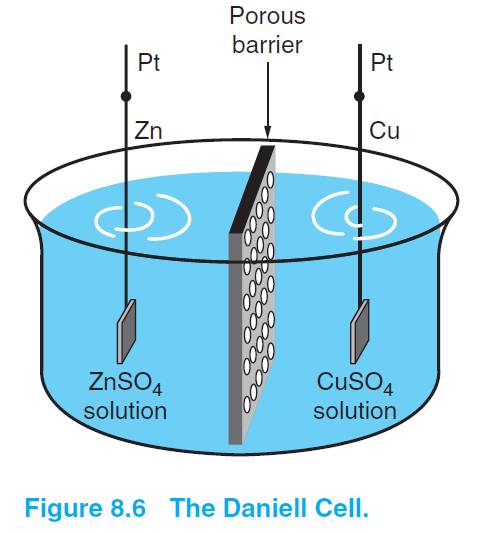
▲the Daniel cell
拿经典的丹尼尔电池为例,说明一下液接电势是怎么产生的?
这个电池包含两种电解质溶液且通过多孔膜分开,因为SO42-和Zn2+迁移速率不同,因此也会产生液接电势。
液接电势有什么危害?
对于测量原电池的电势差时需要考虑液接电势:
那么,有没有什么办法可以消除液接电势?
答案是液接电势不可以消除,只能降低到忽略不计。
使液接电势降低到可以忽略不计的就是盐桥,一般的双液电池都需要盐桥。

▲带盐桥的双液电池
盐桥是一个倒置的U型管,其中包含一个电解质,并将两个半电池连接在一个电池中。
盐桥内一般装有高浓度(饱和)KCl溶液,使用时插入原电池左右两室中,这样一来盐桥两端就会形成两个液接电势。因为KCl溶液浓度很大,所以在迁移速率上占优势,又因为K+和Cl-的迁移速率几乎相等,所以形成的两个液接电势大小几乎相等,方向相反,净液接电势几乎为零(而没有盐桥的液接电势高达40mV左右)。
讲到这里,盐桥的作用也就浮出水面了。
1、形成闭合回路
2、平衡电解质溶液离子浓度
3、大大降低液接电势
最后,关于盐桥使用的注意事项:
1、盐桥制备时,琼脂液不能有气泡,两头饱满不能凹陷,以免增加额外电阻。
2、制备盐桥的电解质正、负离子的电迁移率,迁移数必须近似相等,KCl是理想的电解质。
3、盐桥的盐浓度必须要大,一般是饱和溶液。
4、盐桥不能反复使用,一个盐桥只能供一次测定。

- 全部评论(0)
