关于金属腐蚀与防护的问题讨论
时间:2021-10-29 14:29 来源:未知 作者:王笃年 点击: 次 所属专题: 金属腐蚀与防护
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题1、钢铁表面的电解质溶液呈碱性时,会不会发生吸氧腐蚀?
答案是“会”,钢铁只要暴露在空气中且表面附有水膜,就一定会发生吸氧腐蚀。大家之所以会提出这样的问题,与教科书里关于电化学腐蚀类型的分析、描述不全面有关。
我们知道,钢铁不管是发生吸氧腐蚀还是析氢腐蚀,负极的电极方程式都是Fe-2e-=Fe2+,当电解质溶液中H+浓度很大时,正极反应以H+得电子为主:2H++2e-=H2↑,而H+浓度较小(溶液酸性不强)时,则以溶解氧得电子还原为主:O2 + 4e-+2H2O=4OH-。一般情况下,O2 在水中的溶解度受电解质酸碱性影响不会很大,故碱性溶液里依然存在溶解氧,也会发生吸氧腐蚀。
试想,如果碱性条件下钢铁不会发生电化学腐蚀 ,海洋中航行的轮船就不需要进行防护了(因为海水大都呈弱碱性) ,而事实不然。
问题2、 吸氧腐蚀会不会伴随析氢腐蚀而发生?
当然会,析氢腐蚀与吸氧腐蚀之间并不相互矛盾 ,只是不同条件下以哪一种方式为主的问题。可以说 ,只要钢铁暴露在空气中 ,且表面附有电解质溶液,就一定存在吸氧腐蚀。至于析氢腐蚀是否发生,则取决于电解质的pH,只有在pH很小(电解质酸性很强)的条件下,才会以析氢腐蚀为主,并不排除伴随着吸氧腐蚀。
问题3、浸泡在食盐水中的铁钉,哪个部位腐蚀最快?哪个部位最先产生铁锈?
如图1 所示,将铁钉浸泡在食盐水中,凡是与液体接触的部分,Fe均会发生离子化 :Fe-2e-=Fe2+,电子则沿着钢铁传导、分布到铁钉内部各部位。
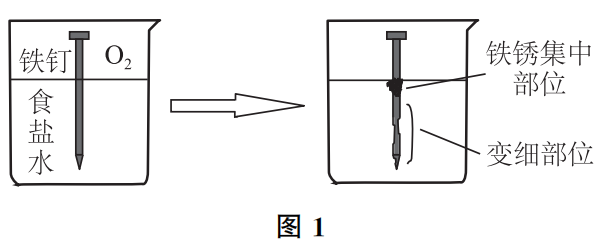
由于靠近液面的部分,O2 容易得到补充,主要发生吸氧过程:O2 +4e-+2H2O=4OH-,这样铁钉内部的电子就源源不断地向此部位集中,靠近液面处OH-浓度较大,与Fe2+结合形成Fe(OH) 2 :Fe2++ 2OH-=Fe(OH) 2 ,接着发生以下氧化过程:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
所以,铁锈主要集中在液面下靠近液面的部位,而腐蚀变细的部位则包括整个水下部分。
问题 4: 牺牲阳极的阴极保护法中,用于保护船体的锌块可不可以放置在舱内?
这可真是异想天开,要运用“牺牲阳极的阴极保护法”,却梦想不牺牲阳极(将其放置在船舱内,不与电解质接触,不被腐蚀而永久起作用)。
要回答此问题,我们得先弄清楚牺牲阳极的阴极保护法的原理:所谓牺牲阳极,就是选择一种比铁活泼的金属,一般选用锌或镁,将其与需要保护的钢铁制品组成电池(一般并非像教科书里画的那样通过导线连接,而是直接焊接在钢铁制品的表面,缩短二者之间的距离,减小电阻),当整个体系与电解质溶液接触时,该阳极材料因为比铁容易失去电子,所以率先离子化(“牺牲”自己),把电子传导到钢铁的表面,使钢铁表面负电荷密度增大,钢铁作为正极不发生反应,于是就避免了钢铁的腐蚀.
如果把选定的阳极材料搁置在船舱内,让它不与电解质溶液接触,那么它如何发生离子化呢?电子如何传递到钢铁制品表面,如何达到保护钢铁材料的目的呢?
问题 5:外接电源的阴极保护法中,通入多大的电流合适?
根据上述问题4的分析,在外接电源的阴极保护法中,外接电源的电压高低,显然以控制被保护的金属不发生离子化为准最合适。
因为外接电源与惰性辅助阳极、被保护金属部件、电解质构成闭合回路,所以理论上,不应该让回路中有明显的电流。至于实际操作中具体控制在多大范围,需要依据理论计算结果并结合多年的经验积累作出判断。

- 全部评论(0)
