物质的量的“前世今生”!
时间:2022-08-06 10:03 来源:未知 作者:化学自习室 点击: 次 所属专题: 物质的量
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
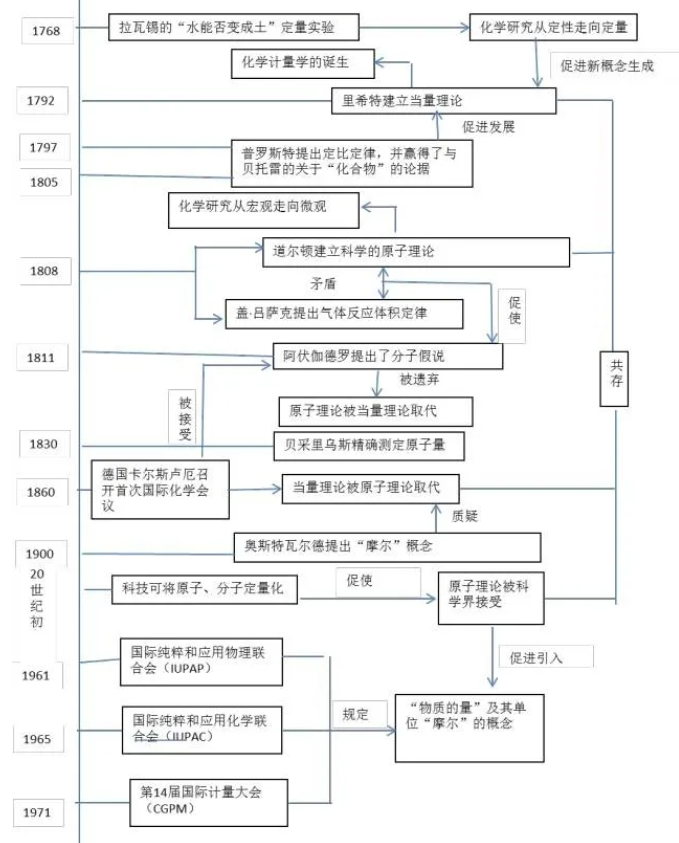
1768年,拉瓦锡做了证明水可能变成土的实验,使得化学从定性走向定量。其实验过程:把一个叫pelican的玻璃容器称重,其中装入称过重的已蒸馏过八次的水,把容器慢慢加热,并将容器密封好,再称量。然后在列氏60- 70℃保存101天之后发现从水中逐渐析出一种白色固体,其量与时俱增。于是将这个容器冷却并称重,总质量并没有改变。把水倒出后,烤干并称重,pelican的质量减少17.4喱(约为1.131克)。白色粉末干燥后,只重4.9喱(约为0.319克)。把水先放在玻璃蒸馏瓶中,最后放在称过的盘子中蒸发,剩下15.5喱(约为1.008克)残渣。但是4.9+15.5=20.4,这比pelican减少的重量多3喱(约为0.195克)。他把这多出来的3喱解释为有些水与固体化合和用来蒸发水的玻璃蒸馏器溶解下来的物质,因此,他认为“土”是从玻璃容器上被水溶解下来,而不是从水本身得来。

1792年,里希特提出“当量理论”,即元素彼此之间必有固定的质量比。所有的化学反应都是按照一定重量比进行的,用“当量重量”来表示。其标志着化学计量学的诞生。
1797至1802年期间,法国化学家普鲁斯特提出了定比定律(化合物中各元素质量组成固定不变)。但是遭到贝托雷反对,他认为物质并无一定组成,而是根据制造方法的不同(比如每次交换原料的配比)而发生种种变化。(法国分析化学家。1754年9月26日生于昂热,1826年7月5日卒于昂热。1774年在巴黎学习化学。后迁居西班牙,先后在塞哥维亚、萨拉曼卡等地的一些学校中任教;1789年在马德里任教授。在马德里期间,西班牙国王查理四世为他装备了非常豪华的皇家实验室,任命他为实验室主任。因此,他的实验室极适合于做定量分析工作。1806年普鲁斯特离开西班牙访问巴黎。1808年法军攻占马德里时,皇家实验室被毁。1816年被选入巴黎科学院。普鲁斯特的主要贡献是确立了定比定律。从A.-L.拉瓦锡和18世纪后期的著名化学家出版的著作中可以明显看出,化合物有固定组成的概念已被普遍接受。然而,当时法国的化学权威C.-L.贝托莱关于化合物的组成可变的观点仍很流行。普鲁斯特的更广泛、更系统和更精密的研究,使定比定律得以在严谨的科学实验的基础上确立。)
1805年,由于贝托雷的立论是建立在错误分析结果的基础上,使他在判别化合物同混合物之间的区别上出现纰漏,普鲁斯特赢得了“论战”。

1808年,英国画家道尔顿基于里希特和普鲁斯特的研究成果提出了原子学说,即认为:1)所有物质都不能无限分割,都要达到一个最后的极限。这个极限的微粒按照自古以来的说法叫做原子;2)原子的种类很多;3)化合物是由其组成元素的原子聚集而成的“复杂原子”,在构成一种化合物时,其成分元素的原子数目保持一定,而且保持着最简单的整数。
法国的盖·吕萨克和德国的洪堡共同进行卡文迪许的氢气和氧气结合生成水的实验,结论是反应中100体积的氧需要199.89体积的氢,即需要几乎恰好是200体积的氢。并在实验的基础上得出假说:在同温同压下,相同体积的不同气体含有相同数目的原子。但该假说遭到了道尔顿的强烈反对,认为在氢和氧化合生成水蒸气时,1体积氧相当于含有1个氧原子,则2体积的氢就相当于2个氢原子,所生成的2体积的水蒸气就相当于含有2个水的复杂原子。这样,1个水的复杂原子也就必然是由1个氢原子和半个氧原子所构成的。半个氧原子!原子能分裂成两半吗?因此两者产生争论。
1811年,阿伏伽德罗在道尔顿与吕萨克的矛盾契机上提出了分子假说,即同温同压下,相同体积的任何气体都含有相同数目的分子。但是该假说提出之后受到了道尔顿等学术权威的反对。
1860年,在卡尔斯鲁厄国际化学大会上,意大利化学家康尼扎罗大力宣传阿伏伽德罗提出的分子假说,这时候分子假说才受到认可,导致当量理论被原子理论取而代之。
1900年,德国物理化学家奥斯特瓦尔德 “摩尔”概念在原子理论与当量理论拥护者的争论中应运而生。但是他是当量学派的拥护者,根本不相信原子分子学说。从名字就可以看出摩尔(mole)是“big mass”,而分子(molecule)的意思是“small mass”,两者意思正好相反。
1909年,法国物理化学家吉·佩兰(Jean Perrin)提出1g分子物质中所含有的粒子数是一个常数N,并用实验测出了分子大小和阿伏伽德罗常数。为了纪念阿伏伽德罗,他建议将这个常数命名为阿伏伽德罗常数,证实了分子的客观存在,这时奥斯特瓦尔特才认可了原子分子学说,故“摩尔”定义必然是以克表示的质量。数值上等于相对摩尔质量,完全不是现代意义上的与原子论密切相关的“摩尔”概念。
1961年,国际纯粹和应用物理联合会(简称IUPAP)首先对“物质的量”及“摩尔”做出以下建议:在化学和分子物理领域,“物质的量”也是一个基本物理量。基本单位是“摩尔”,符号为mol。1摩尔物质中所包含的分子数(或离子、原子、电子以及其他类似离子)与12g碳-12的原子数目相等。
1965年,国际纯粹和应用化学联合会(简称IUPAC)也认可接受了这一基本物理量。1971年,由41个国家参加的第14届国际计量大会(简称CGPM)正式宣布:“物质的量”就成为了国际单位制中的一个基本物理量,其单位为“摩尔”。

- 全部评论(0)
