物质的量常见易错点分析汇总
时间:2021-06-03 09:16 来源:未知 作者:化学自习室 点击: 次 所属专题: 物质的量
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、化学计量
正误判断,正确的打“√”,错误的打“×”
(1)考查气体摩尔体积适用条件及物质的聚集状态
①常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA( )
②常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA( )
③标准状况下,22.4 L 二氯甲烷的分子数约为4NA个( )
答案 ①√ ②× ③×
(2)考查物质的组成和结构
①1 mol 羟基与1 mol 的氢氧根所含电子数均为9NA( )
②28 g 乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA( )
③1 mol Na2O 与1 mol Na2O2的固体中含有的阴离子数均为NA( )
④1.7 g H2O2中含有电子数为0.9NA( )
⑤1 mol NaCl中含有6.02×1023个NaCl分子( )
答案 ①× ②√ ③√ ④√ ⑤×
(3)考查氧化还原反应电子转移数目
①标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( )
②1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子( )
③常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA( )
④1 mol Cl2与足量Fe反应,转移的电子数为3NA( )
答案 ①× ②√ ③√ ④×
(4)考查电解质溶液中粒子的数目
①1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA( )
②1 L 0.1 mol·L-1氨水含有0.1NA个OH-( )
③常温下,10 L pH=1的硫酸溶液中含有的H+的数目为2NA( )
④常温下,10 L pH=13的NaOH溶液中含有的OH-的数目为NA( )
⑤1.0 L 1.0 mol·L-1的Na[Al(OH)4]水溶液中含有的氧原子数为2NA( )
⑥1 mol·L-1NaCl溶液中含有NA个Na+( )
答案 ①× ②× ③× ④√ ⑤× ⑥×
(5)考查化学反应前后微粒数目的变化
①50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA( )
②某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA( )
③1 mol Cu和足量稀硝酸反应产生NA个NO分子( )
④0.1 mol H2与0.1 mol I2蒸气在密闭容器中充分反应后,分子总数为0.2NA( )
⑤常温常压下,将0.1 mol NH3与0.1 mol HCl混合充分反应后,分子总数为0.2NA( )
答案 ①× ②× ③× ④√ ⑤×
二、溶液配制
正误判断,正确的打“√”,错误的打“×”
(1)10 mL 质量分数为98%的H2SO4,用10 mL 水稀释后,H2SO4的质量分数大于49%( )
(2)在标况下,将22.4 L 氨气溶于1 L 水中,得到1 mol·L-1的氨水( )
(3)实验室用蔗糖配制100.0 g 溶质的质量分数为10%的蔗糖溶液,必须用到:100 mL 的容量瓶、托盘天平、玻璃棒、烧杯和胶头滴管( )
(4)配制0.1 mol·L-1的Na2CO3溶液480 mL,需用500 mL 容量瓶( )
(5)配制0.100 0 mol·L-1碳酸钠溶液时,将溶液转移到容量瓶中需用玻璃棒引流( )
(6)用容量瓶配制溶液时,若加水超过刻度线,立即用滴管吸出多余液体( )
(7)用pH=1的盐酸配制100 mL pH=2的盐酸只需要100 mL 容量瓶、烧杯、玻璃棒、胶头滴管( )
(8)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小( )
(9)配制浓度为0.010 mol·L-1的KMnO4溶液时,称取KMnO4固体0.158 g,放入100 mL 容量瓶中,加水溶解并稀释至刻度(2017·全国卷Ⅲ,9D)( )
答案 (1)√ (2)× (3)× (4)√ (5)√ (6)× (7)× (8)× (9)×
二、常考笔答题答题语言再规范
1.实验室需要0.5 mol·L-1的NaOH溶液470 mL,配制时应称量___g NaOH,称量时需要___、___、__(填仪器名称)。
答案 10.0 托盘天平 小烧杯 药匙
2.检查容量瓶是否漏水的方法:___。
答案 向容量瓶中加入适量水,盖好瓶塞,右手食指顶住瓶塞,左手托住瓶底,将容量瓶倒转过来看瓶口处是否有水渗出,若没有,将容量瓶倒立,将瓶塞旋转180度,重复上述操作,如果瓶口仍无水渗出,则此容量瓶不漏水
3.配制一定物质的量浓度溶液定容时的操作是____。
答案 往容量瓶中缓慢加蒸馏水,等液面离容量瓶瓶颈刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
4.某医疗小分队用溶质质量分数为0.5%的过氧乙酸溶液对灾民的居住环境进行消毒。要配制溶质质量分数为0.5%的过氧乙酸溶液300 kg,需溶质质量分数为15%的过氧乙酸溶液__kg,配制的主要步骤是____、___、___。
答案 10 计算 称量(量取) 溶解(稀释)
解析 稀释前后溶液中溶质的质量不变,设需要溶质质量分数为15%的过氧乙酸溶液的质量为x,则15%×x=300 kg×0.5%,x=10 kg;配制的主要步骤:首先根据溶质的质量=溶液的质量×溶质的质量分数,计算需要过氧乙酸溶液的质量和水的质量,再换算为体积,并进行称量、量取,然后混合溶解。
5.为测定镁铝合金中铝的含量,设计如下图所示的实验:
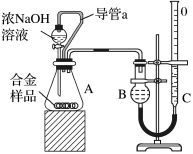
(1)锥形瓶中发生反应的化学方程式:________。
(2)读数前调平B、C装置液面的方法是______,其目的是________。
(3)若拆去实验中导管A,使测得气体体积_____(填“偏大”“偏小”或“无影响”)。
答案 (1)2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑
(2)上下缓慢移动量气管C 使B内的气压等于外界大气压
(3)偏大

- 全部评论(0)
