原子半径分类及影响因素
时间:2022-01-02 19:15 来源:未知 作者:化学自习室 点击: 次 所属专题: 半径分 大小 比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原子半径:是指以实验方法测定的相邻两种 原子核间距离的一半。从理论上说,核外电子无严格固定的运动轨道,所以原子的大小无严格的边界,无法精确测定一个单独原子的半径,因此通常所使用的原子半径数据只有相对的、近似的意义。
一、原子半径分类
根据不同的标度和测量方法,原子半径有3种原子半径表达,常见的有范德华半径、共价半径、金属半径等。
1、共价半径:
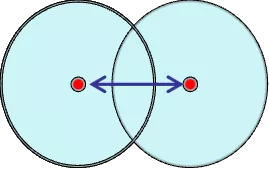
同种元素的两原子以共价键结合时,其核间距的一半。适用非金属元素。测定单质分子中两个相邻原子的核间距一半。
2、金属半径:
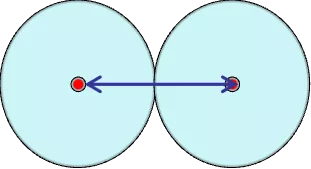
在金属晶体中,相邻两原子核间距的一半称之。适用金属元素。固体中测定两个最邻近原子的核间距一半。
3、范德华半径:
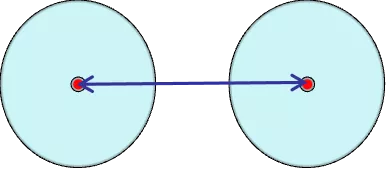
在分子晶体中,相邻分子的两原子核间距的一半。单原子分子 ( He,Ne 等 ),原子间靠范德华力,即分子间作用力结合,因此无法得到共价半径。在低温高压下,稀有气体形成晶体,原子核间距的一半定义为范德华半径。
二、影响原子半径大小的因素:
影响原子半径的两个因素:
①核电荷数 Z 增大,对电子吸引力增大,使得原子半径 r 有减小的趋势。
②核外电子数增加,电子之间排斥力增大,使得原子半径 r 有增大的趋势。
以 ① 为主。只有当 d5,d10,f7,f14 半充满和全充满时,层中电子的对称性较高,这时 ② 占主导地位,原子半径 r 增大。
三、原子半径在周期表中的变化
①同周期中:即同周期中从左向右原子半径减小。
主族元素:从左到右 r 减小;从上到下 r 增大。
过渡元素:从左到右r 缓慢减小;从上到下r略有增大。
②同一族:
1) 主族:从上到下,外层电子构型相同,电子层增加的因素占主导,r增加。
2) 副族:第四周期到第五周期, r增大,第五周期到第六周期, r接近。
短周期主族元素,电子填加到外层轨道,对核的正电荷中和少,有效核电荷 Z* 增加得多。所以 r 减小的幅度大。长周期过渡元素,电子填加到次外层轨道,对核的正电荷中和多,Z* 增加得少,所以 r 减小的幅度小。
即短周期主族元素原子半径平均减少幅度 10 pm ,长周期的过渡元素平均减少幅度 4 pm 。

- 全部评论(0)
