通俗解释有机化学理论
时间:2022-04-26 07:49 来源:未知 作者:化学自习室 点击: 次 所属专题: 有机化学基础
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
作者:叶枕流
链接:https://www.zhihu.com/question/26998987/answer/34855240
来源:知乎
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。
楼主现为大学有机老师,本科和博士都是有机化学专业,高二参加化学奥林匹克竞赛时,已自学完大学有机课程,考研的有机试卷当作平常练习题已无压力。那么在高二时还未学过高数和大学物理的情况下,是如何着手进行高效自学的呢?
简单来说,有机化学的得名源于化学发展早期的“生命论”:那时认为那些冷冰冰的矿石啥的,实验室能够人工鼓捣的都属于无机范畴,而那些生命体所生成的化合物比如乙醇,醋酸,尿素,糖等,则必须来源于生物体的代谢等。所以如图:由器官(有机体organism)衍生出了形容词organic有机的,进而衍生organic compound有机化合物,而研究这些化合物的学科,则是organic chemistry有机化学(对应的,无机化学则是Inorganic chemistry,否定前缀)。所以基于这样的原因,有机便有了非人工、纯天然的意思;于是现代商家为了炒作,把同样是化肥和农药搞出来的农产品,冠上有机两字,价格就飕飕往上涨,实际质量却可能更糟糕。有机食品、纯天然非转基因等等,学过生物或者化学的同学,一定要有基本的抗洗脑能力哈。
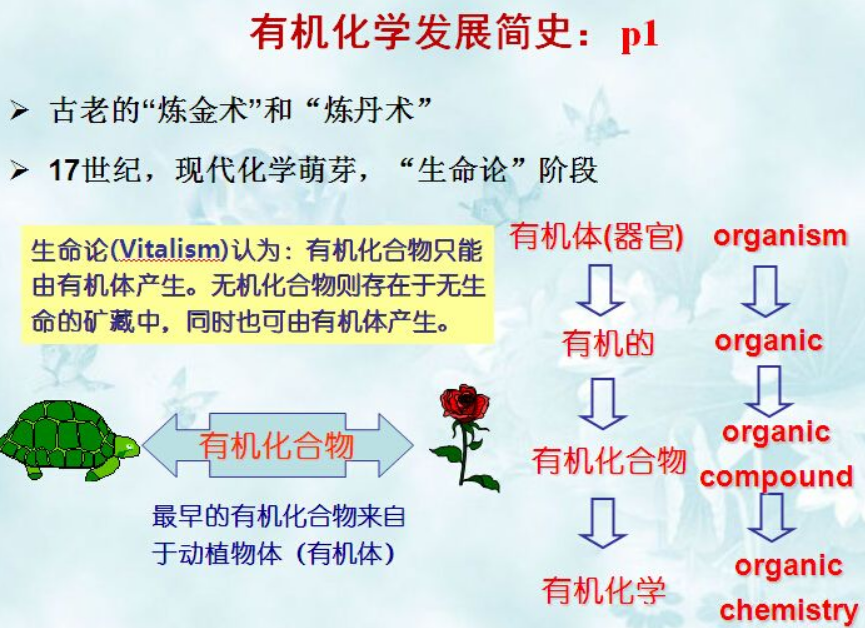
不过在1828年,德国化学家Wohler做浓缩NH4+CNO-实验时,一不小心却得到了尿素(NH2CONH2),这下可不得了啦,化学家一不小心闯进了上帝造物的领域,于是生命论学者争辩到,尿素是人体的排出体外用不到废物,没有生命力不算;于是CH3COOH和油脂等陆续被有机化学家在瓶瓶罐罐里合成出来,彻底让有机化学前面的有机两个字,失去了其原本的意义。但日久情深,有机两字也就沿袭了下来。
某种程度上来说,有机化学从1828年开始,就与合成有了最密切的关系,时至今日,有机化合物数量已经逼近1亿的数量,每年新增化合物数百万,其中90%以上都是有机化合物。
其实大学有机,真正用到高等数学和物理的并不多,我们只要记住中学学习元素周期律学到两大基本常识就足以应付了:电子云的概念和s、p轨道的空间分布;稀有气体是最稳定的元素,对于C(4),N(5),O(6),F(7)都希望通过和其他原子成键共用电子,达到最外层满足Ne(8)八隅体的稳定结构,相应的需要形成8-4,8-4,8-6,8-7根化学键。对于它们来说,稀有气体那种睡觉睡到自然醒,数钱数到手抽筋(电子富足,完美无缺)的人生,就是他们做梦都想要去达成的至高目标。
为了便于理解,以Ne(8)为例,我们假设最外层的电子为未婚青年(里层的都配对也就是都结婚了),如果能够形成4对夫妻,则是最理想的情况(从元素周期表知道,最外层电子数最大为8,这个是由薛定谔方程解出,暂时我们不管);s、p轨道,由于能量差异(s长得匀称,好看;p轨道只是特定角度看去才不错),s总是比p轨道优先成键(优先结婚)。出于对人性的了解,我们都知道,p一般不太嫉妒远比它们有优势的s,但px,py,pz三者之间出身一样,则必须享受同等待遇,要么都单身(N 2s22p3),要么都成对(Ne 2s22p6),决不能容忍个别成对,个别却单着(O 2s22p4, F 2s22p5)。
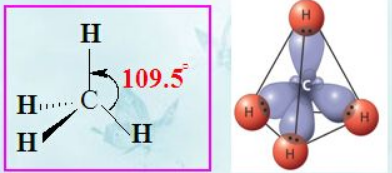
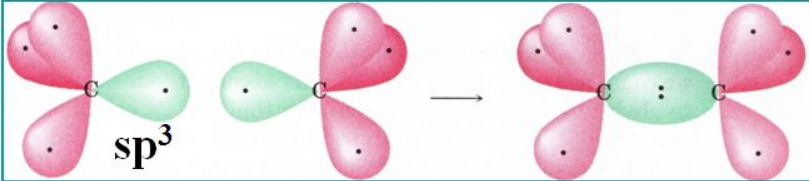
对于屌丝C来说,必须从外面引进4个电子才可以向Ne(8)这样的高富帅看齐,遵循“对称就是和谐"的原则,有机村里的C村长,高瞻远瞩地把所有适婚青年 (s2p2,最外层4个电子)召集起来,然后把已经内部搭对的s2拆散,和px,py,pz一起改头换面的包装出四个富有吸引力的适龄青年(每人都是sp3的1/4),把最光鲜的穿在外面,把寒碜的藏起来。各自找个方向出去求偶,比如甲烷,形成四根C-H共价键从而满足4对夫妇共八人的和谐一代。为了最大减少彼此求偶时的不必要摩擦(各自之间电子相互排斥),四个方向最理想的就是正四面体了。
与甲烷的幸运相比(1C4H),不同的C有不同的不幸:
乙烷CH3-CH3,每个C形成3根C-H键以后,不得不捏着鼻子,C-C之间来个同性婚姻。
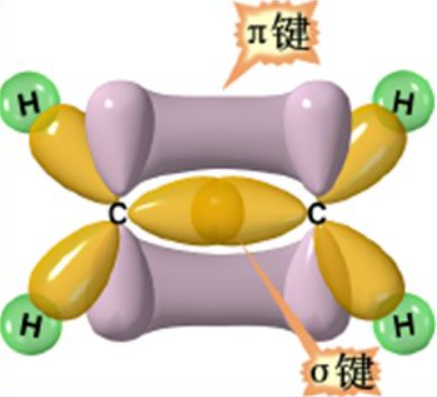
乙烯CH2=CH2,在乙烷基础上又少了2H, C-C之间不得不再合作一次;由于电子排斥的原因,电子云空间排布必须彼此错开,所以聪明的C村长,留出一个p轨道,把其余的sp2进行无差别杂化,3个轨道,3个方向彼此干扰最小的,自然是正三角形,各自如愿成婚(σ键,被法律认可的婚姻,相对稳定)。刚留出来的p轨道,和三角形所在的平面垂直从而错开彼此的求偶路线;这两个C的p轨道,由于距离和社会道德阻碍等原因,没法光明正大的成婚(空间原因无法再头碰头),只能凑合着过露水姻缘(只好肩并肩形成π键),这样的露水姻缘,一旦各自有机会重新找到合适的情侣,则就会被拆散(π键容易被破坏)。为了方便,乙烯这样C和C之间,由一对合法婚姻(σ键)和一对露水姻缘(π键)所形成的两对共价键,我们称之为双键。
乙炔则更惨,C均比乙烯还少1H,不得不在乙烯的基础上,再添加一段露水姻缘,也就是说,C的两个p轨道,和另一个C的两个p轨道,相应地组合成了两对野鸳鸯。C村长把剩下sp两青年,改头换面,让他们朝相反方向(180度,电子间排斥最小)努力求偶,其中一个幸运和H结成了夫妻,而另一个不得不结成C-C之间的同性婚姻。为了方便,乙炔这样C和C之间,由一对合法婚姻(σ键)和2对露水姻缘(π键)所形成的3对共价键,我们称之为叁键。
有机化合物种类繁多的根本原因,在于C的最外层是4个电子,可以通过各种各样的方式和各种各样的原子结合(C,H,O,N,S,P,X卤素,M金属)。
学习有机,就应该从最难的机理入手,开头虽然有点难,但花点苦功一旦上手以后,整个有机的学习,也就豁然开朗了。
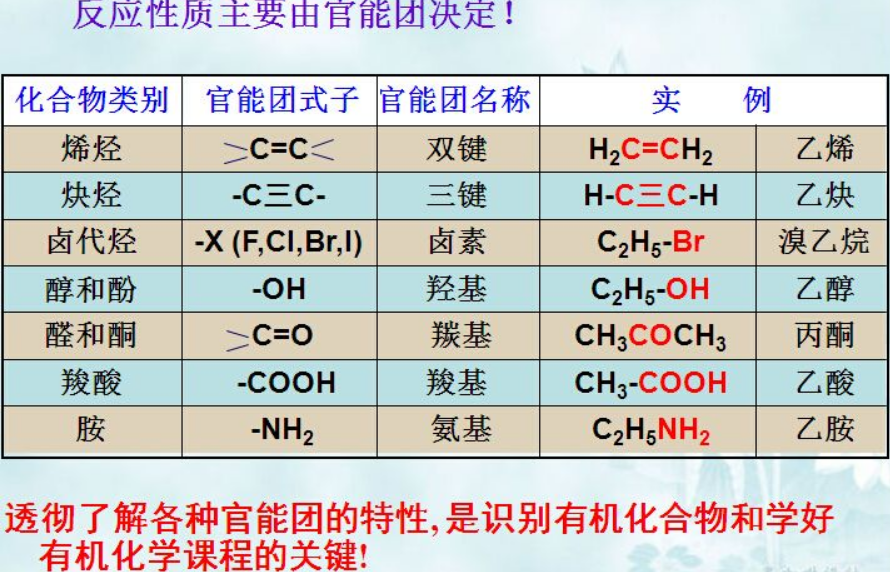
有机机理主要就三种:碳正离子(自由基类同)、碳负离子和没有明显正负离子之分的协同反应(比如4+2 Diels-Alder 反应,3,3-重排反应等);掌握了这些,也就基本掌握了记忆有机知识的规律。说到规律,我们先来说有机化合物命名的规律;有机化学和其他自然科学一样,早期是从日本那边借鉴过来,再经过民国时文化底蕴深厚的大师们适当增益,以决定化合物主要化学性质的官能团依次分类为:
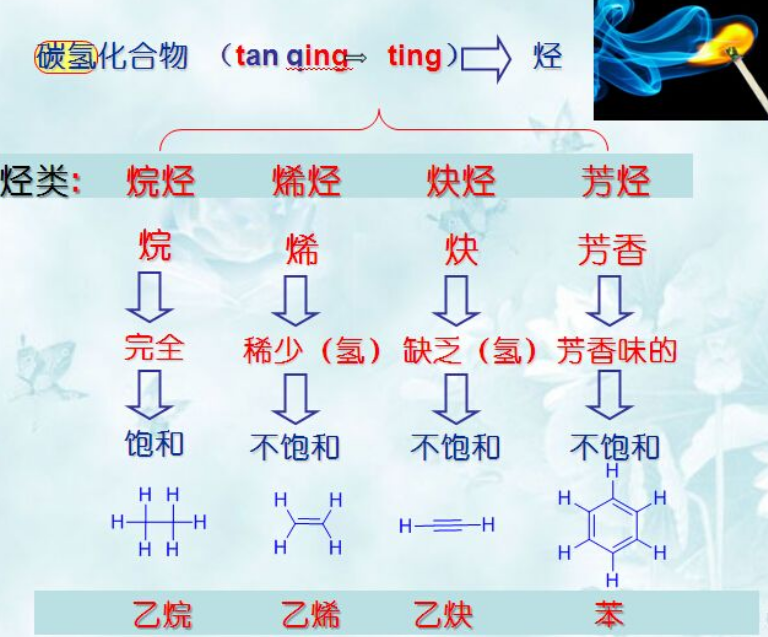
1)烃(分子仅含C和H,取tan的声母、 qing的韵母组合成ting,汉字取氢字下部为读音,部首取火表明其易燃烧的特性):
a) 烷烃(烷,完字表示具有(全部为单键时)最大的氢数,完整无缺)
b) 烯烃(和烷烃相比,分子中由于多了C=C双键,从而相应少了2H,故用稀少的希来构成汉字)
c) 炔烃(和烷烃相比,分子中由于多了CC叁键,比稀还要缺2H,故取字为炔);
d) 如果分子内含有n个C=C双键或叁键,就叫n烯或n炔;若是同时含有m个双键和n个叁键则称为m烯-n炔;举例来说,n烯取值为二烯,这二烯中的两个双键如同两个国家,隔得太遥远(间隔2个C-C单键以上)彼此没有联系,各自发展各自的,和普通单烯并没有什么区别,不值得特别重视;而如果挨得太近,两个双键直接连在同一个C上,就如巴以国家间彼此争夺边界领土,往往不稳定,命名为联烯(中科院的麻生明士专门研究它);而如果距离不近不远(两双键中间间隔一个单键),这就好比中间间隔一个太平洋的美国和日韩以及东南亚国家,或者中国和巴基斯坦等,相互间互补有无,却不用担心利益冲突,往往就可以成为密切的战略伙伴关系,这种关系,在有机化学里称为“共轭”(本意:两头牛背上的架子称为轭,轭使两头牛同步行走。共轭即为按一定的规律相配的一对。通俗点说就是孪生。),比如1.3-丁二烯4个p电子在四个C上顺畅流动,就如国家间面签的自由行,看着就是那么的和谐和稳定。
e) 环烃,故名思议,就是C骨架首尾相连,如同贪吃蛇的嘴衔住了自己的尾巴,形成了一个环。环烃相应包括:环烷烃、环烯烃和环炔烃;由于成环首尾互助,比相应的开链烃节省了2H。环烃就好比大锅饭,虽然比各家做各饭可以很有效的节省一些重复的炊具购买等,但每个碳就和每个人一样,都有自己的生物天性,拘束得太过,大家就不干了。对于碳来说,天性就是不同杂化的碳,必须满足其相应的成键角度:单键sp3杂化正四面体109.5度,双键sp2杂化正三角形120度,叁键sp杂化直线型180度。对于环烷烃来说,一般5、6个碳组成的环,既能达到节省不必要的重复开支(5C共同节省了2H,每C节省0.4H),彼此间又有足够的弹性空间保持彼此的个性(键角),所以非常和谐稳定,在有机化合物中比比皆是,故称为普通环;3、4个C组成的环,由于空间太小,强行凑在一块彼此个性(键角)被压抑得太厉害,往往容易散伙,不常见,因其比56小,命名为小环;7-12C组成的环,空间倒是能满足,但C均节省H的效率相对一般,不上不下,故名为中环;13C以上,C均节省H的效率过于鸡肋,所以在有机化合物当中也就较为少见,以其C数多名为大环。相应的,分子中含有两个环以上,就叫双环或者多环,多环间共用一条边,边为桥连通两边取名为桥环;而双环间共用一点(C原子),因为形似两螺尖尖相对,故名为螺环。
f) 芳香烃苯、萘、蒽、菲等,具有草木芳香味的一类具有特殊稳定性的烃类化合物,草字头表明性质,本、奈、恩和非等表示音译过来的读音),其实芳香烃是共轭烯烃与环烃的结合体,以苯为例:由1,3,5-己三烯,首尾相连组成苯环(C6H6,当时苦思冥想其分子结构的化学家凯库勒到贪吃蛇首尾相连,受到启迪,给出了苯环的结构),其特殊芳香性,来自于4n+2的休克尔规则;其中苯环芳香性最显著,因为共轭烯烃的P电子数必然为偶数,6元环完美满足每个sp2杂化120度键角的需求,首尾相连让电子从123456以后迅速回到1,然后234561;和1,3,5-己三烯相比,不得不从,654321这样退回来,大大提高了效率,而这额外的效率,就是芳香性(特殊的稳定性)。而如果两个苯环共用一条边(2C组成),则形成了萘,三个苯环并排相连,则称为蒽等,这样苯环密集堆积在一起,取其稠密的意思,命名为稠环。而如果苯环与苯环之间是通过一根单键联系在一起,则称为联苯。
2)烃类的含氧衍生物(糖、醇、醛、酮、酸、酯等):
其他有机化合物都是烃类的C-H,其中的H被相应官能团替代的衍生物。比如乙烷(CH3CH3)的一个C-H被C-OH取代,就成了乙醇(CH3CH2OH);古代文明里从食物酿造了酒,而酒中精华其味醇厚,故酒精也就称为乙醇;分子中含有两个OH以上则称为二醇,三醇。。。其中比较特殊的是,1,2,3-丙三醇在生活中非常常见,拥有其俗名甘油(其实就是化妆品中保湿的主要成分)。而如果酿酒时间过长,乙醇就会被空气氧化成醋酸(CH3COOH),又称为乙酸,这个大家都很熟悉;大家在炒菜的时候,会加一勺料酒和陈醋,在锅里加热后散发出浓郁的芬芳,其实是乙醇和乙酸加热时缩合掉一个水分子后生成乙酸乙酯(CH3COOCH2CH3),乙酸乙酯其实也就是茅台等名贵白酒散发出浓郁芬芳的主要原因;而甘油的高级脂肪酸酯,则是动物脂肪的主要组成部分,大约是这个原因,酸和醇的缩合产物,取名为酯(酒字旁表示来源于酿造,旨表示读音,脂)。酯在生活中极为常见,比如各种水果成熟时散发的香气,就是相应的酯,比如香蕉的乙酸异戊酯,香梨的乙酸丙酯,苹果的丁酸甲酯等(水果没成熟时多为成分主要为酸,这时又酸又涩甚至会吃坏肚子;而种子发育成熟后,则生成具有浓郁芬芳的酯吸引动物来吃食以后,代谢产物帮忙果树的种子发芽。),由于其香气,酯不仅用于酿酒(各种果酒),也用于香水等。
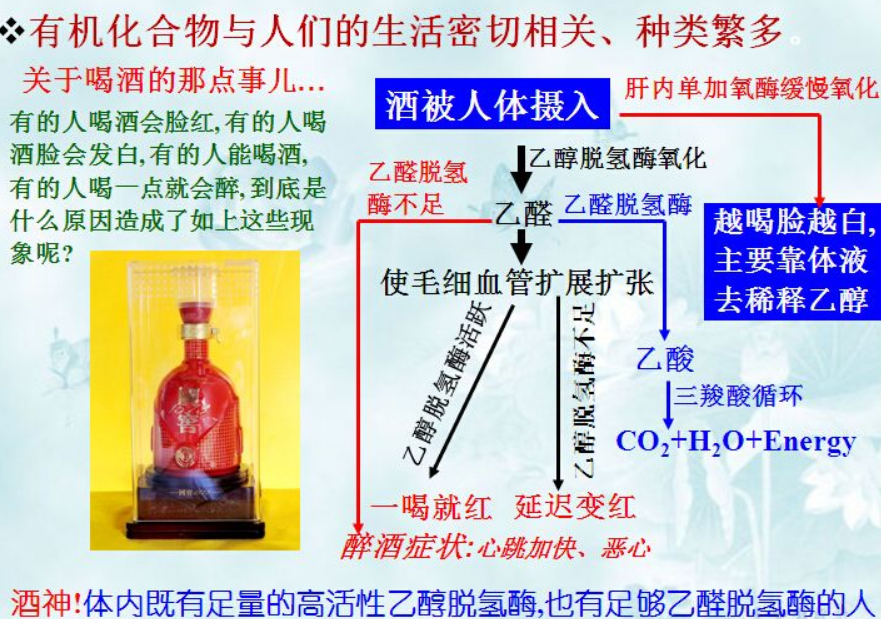
而香水的最主要来源,则是醛,酒字旁表示其来源,多是通过末端的醇(OH在链端的C上,俗称伯醇)氧化,减去2H后得到(比如我们喝酒,乙醇(CH3CH2OH)进入体内后由肝脏先代谢成乙醛(CH3CHO),再把乙醛代谢成乙酸(CH3COOH),最后经过三羧酸循环生成CO2和水),荃则是香草的意思,寓意其来源,生活中常见的有香草醛俗称香兰素),是香草豆的香味成分,有浓烈的香气。这里具有浓烈味道的醛,按比较稀释的浓度配成乙醇溶液成了市场上的香水,使用时碰洒少量到脖子等部位,一段时间内随着乙醇挥发,能够向周围散发出芬芳。醛之所以能够被鼻子强烈识别,可能原因之一就在于其化学性质的不稳定,很活泼从而容易气味识别器官发生分子间的作用而被识别;同时由于其不稳定,也就容易失效,为保持香气,隔一段时间就得重复喷洒。化学中太过活泼的东西往往意味着毒性、易燃或易爆等危险。比如甲醛,装修中常见的污染,长期呼吸容易让人得白血病等;酒精乙醇在人体代谢的初级产物乙醛,也是毒性相当大的物质,如果不能及时转化为乙酸,滞留体内,就会让人心跳加速(脸红)和恶习呕吐。
醇的OH不仅可以连在末端C(R-CH3中的一个C-H被取代成RCH2OH,1个R取代的甲醇,称为1级醇,或者伯醇),而如果OH取代的是RCH2R的C-H,则是RCHOHR,两个R取代,这样我们称为2级醇,或者仲醇;而如果3个R取代的甲醇R3COH,则成为3级醇或者叔醇;因为C最多只能形成四根键,所以不可能有4R取代的甲醇了,也就是4级醇和季醇不存在(4C-R,加上C-OH,形成5根键);另外一种情况,OH取代的不是普通sp3杂化的C-H键,而是sp2杂化比如苯环上的C-H键的话(C6H6苯转化为C6H5OH苯酚),则取名为酚,得名自然是因为芳香化合物特有的芬芳。简单来说醇能被氧化,是因为C-OH的C和O各失去1H从而形成C=O双键,所以,R3COOH的C上已经没有H的就不能被氧化为C=O了。相应的,由RCHOHR氧化失去2H得到的RC=OR,取其英文名tone为同,配以酒,即为酮,最小的如CH3COCH3,3个C数,丙酮。
以上的醛、酮和酸以及酸的衍生物,共有的一个官能团是RCO-,我们把它命名为酰基,,旧称“醯(xi,醋的意思”[acyl],后来大概是由于旧称太难写,在简体字改革中,也就调整成了酰。酰基加个H,就是醛RCHO,加个R就是RCOR酮,加个OH就是RCOOH羧酸,加个OR就是RCOOR酯,加个-NHR就是酰胺RCONHR,加个卤素X就是RCOX酰卤,而再加个酯基则是RCOOOR酸酐;后面这些都是羧酸和醇ROH,胺RNH2,HX(氢卤酸,酰卤太过活泼,反应一般逆向进行)和羧酸RCOOH分子间缩合,减去一分子H2O所形成的衍生物,酸与酸缩合去掉一分子水,也就变得干燥缺水,所以取字为酐。这个缩合反应个可逆反应,如果加水,则反应有利于逆向进行,俗称水解:最经典的比如甘油脂肪酸酯在碱性条件下的水解,生成甘油和脂肪酸的钠盐(也就是肥皂),所以这个水解反应,也就称为皂化反应(PS:因为碱性条件会分解我们的皮肤里的脂肪,所以手接触氢氧化钠溶液后,容易变得滑滑的,就是因为脂肪被水解成肥皂。另外由于肥皂是强碱弱酸盐,显碱性,所以皮肤敏感的人如小孩不宜使用肥皂洗手或洗衣服。)
谈到缩合,不仅羧酸RCOOH自身会缩合,RCOOH会和RCH2OH醇发生缩合,其实醇与醇之间,也会发生缩合:比如两分子乙醇CH3CH2OH,缩去1H2O,变成CH3CH2OCH2CH3,我们称为乙醚,醚字的迷代表的是乙醚的麻醉作用,动物吸多了乙醚会被迷倒。
对于以上含氧的衍生物,我们认识得差不多了,也就有必要进一步了解一下反复出现的一些官能团-OH我们称为羟基,羊字旁,表示含氧的意思,右边部分则表示氢,读音qiang是qing和yang的结合;-C=O,羰基,则是碳(tan)和氧(yang)的结合;-COOH,羧基,则是酸的右边部分(suo)和羊的结合。同学们稍微陌生点的是,ROR的O如何和H+结合生成O正离子怎么称呼呢?答案是金字旁加个羊,也读氧。
在这里,让我们稍微回忆一下,氮(dan)、NH3(氨气 an), NH4+(离子性质和Na+,K+等相似,所以叫铵an,金字旁表示性质同金属离子),所以顺利成章,我们就理解金羊的命名了。除碳原子外,表示带有正电荷的非金属离子,我们统一命名为鎓离子;-onium ion:以上的氧鎓离子,N鎓离子;相应的,对于C=C双键和Br+所形成的三元环的正离子,称为溴鎓离子。
最后,还有一类特殊的含氧衍生物,由于其来源不是出自酿造工艺,而是来自大米小麦等主食的消化代谢产物,具有甜味的糖。糖的分子式一般符合CnH2nOn,看着就是n(C+H2O),所以又称碳水化合物。最常见的有葡萄糖(C6H12O6,醛糖)、果糖(C6H12O6,酮糖),这样分子式一样,但结构不同的化合物,我们称为同分异构体;还有由这样单一的糖,两分子之间缩合掉一分子水而成的麦芽糖(葡萄糖和葡萄糖)和蔗糖(葡萄糖和果糖)。葡萄糖和麦芽糖甜度较差,所以我们吃饭的时候,并不能感受到特别的甜味;而果糖与蔗糖较甜,所以水果和甘蔗等吃起来往往很美味。糖不仅是我们人类主要供能物质,也是微生物新陈代谢的供能物质,因而糖吃多了而不容易刷牙的话容易蛀牙,吃太多消化不了,累积起来的话,容易导致肥胖。而有些糖尿病患者由于缺乏胰岛素不能正常代谢这些糖,是不是他们的人生就彻底告别甜味了呢?答案是不,有机化学家专门合成了一类具有果糖几百倍甜度,而又不会被人体吸收导致能量过剩的化合物,就是我们熟悉的糖精(邻苯甲酰磺酰亚胺)和甜精(乙氧基苯脲(Dulcin)或者甜蜜素等)了。这类人工合成的糖,是正常的食品添加剂,只要量严格控制,食用是无害的;但由于它们并无实际营养,单纯为了甜味而痴迷太过,则显然是不对的。
3)烃类的含氮衍生物(胺、肼、肟、腙、胍、腈、氨基酸等):
R-H的H容易被卤素X取代成相应的卤代烃,也容易被-NO2取代成硝基化合物,不过这两类取代,在有机里属于屌丝的命运,他们的优先级还不如H,只能当作取代基,而不能作为有冠名地位的官能团,我们不多说。
含氮衍生物里最有名的自然是氨基酸了,RCHNH2COOH,我们每天必须补充的营养,来自于各类蛋白先分解成多肽,后再进一步水解成小分子氨基酸。因为最早的含氮衍生物,都是通过生物降解蛋白质(主要是肉)分解得到,比如多肽,用月表明其来源,太表示音译的读音。蛋白质和多肽是不能被人体吸收的,吃进肚子必然被分解成氨基酸,所以那些保健品各类胶原蛋白啊,什么激素啊,多肽啊,都还不吃吃一块猪肉来得有效;同样花钱去买氨基酸更是没有任何意义,吃肉和鸡蛋等,自然就补够了。
相应的,RNH2,氨基为官能团,则取名为胺;胺是蛋白质腐化的产物,一般具有难闻的气味,根据生物进化的本能,闻着很恶心的东西,往往都是有毒的:比如NH2CH2CH2CH2CH2NH2,1,4-丁二胺,俗名腐胺,是顶风臭出几里地的超级臭弹,空气中浓度达到几十个ppm就能把人给熏晕,剧毒;比如1,5-戊二胺,俗称尸胺,是尸臭的主要味道之一。
胺可以看作是NH3的H被烷基R取代的衍生物,1个R取代,RNH2称为1级胺也就是伯胺;2个R取代,R2NH称为2级胺也就是仲胺;3个R取代,R3N称为3级胺也就是叔胺;而如果N上的孤对电子也参与成键,和NH4+类似,形成NR4+,则称为季铵盐,是常见的表面活性剂。以上R一般为烷基,如果换成苯环等芳香基团ArNH2,则称为芳香胺。
相应地,左边月表示来源,右半表示音译读音的衍生物还有:RCN,腈jing(HCN氰的H被R取代);RnH-NH2,肼(联氨H2N-NH2的H被R取代);H2NCONH2,脲,又称尿素;胍(CH5N3)可看做是脲分子中的氧原子被亚氨基(=NH)取代而生成的化合物。胍分子中除去一个氢原子后的基团叫胍基(CH4N3),除去一个氨基后的基团叫脒基(CH3N2)。
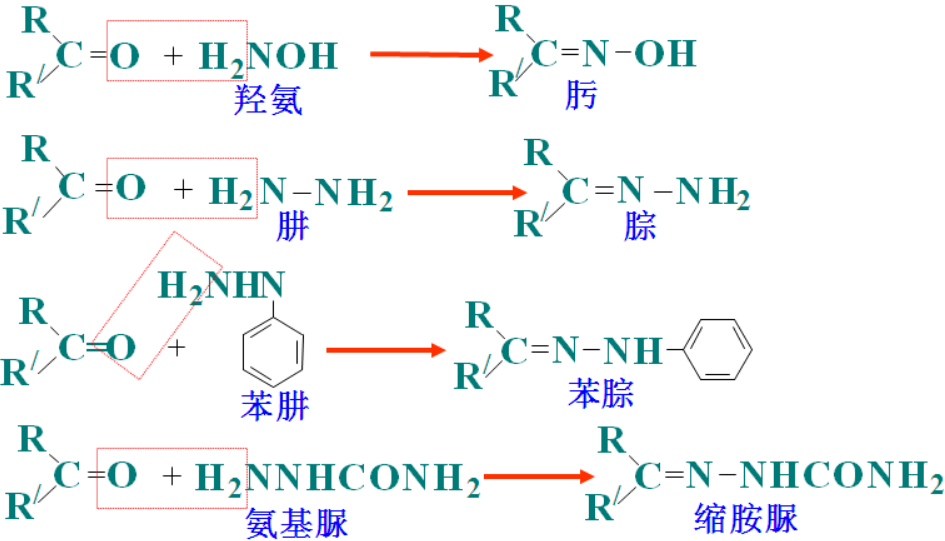
相应的,普通羰基化合物(醛酮)和含氮化合物,缩合掉一分子水,形成的亚胺(C=N-R)类衍生物分别有:R2C=N-OH肟,R2C=N-NH2腙等等。
4)有机砷和有机磷等衍生物
As和P是N的同族元素,具有相应类似的化学性质:和NH3上的N-H被N-R取代得到胺类似,AsH3和PH3被相应烷基取代的,分别取名为胂和膦,偏旁月代表其腐肉般难闻的气味,一般是臭屁的重要组成部分,基本都是剧毒的,所以闻到臭屁,人赶紧掩住口鼻尽量远离,是生物躲避危险的本能:
胂,一般用于有机合成、军用毒气,及应用于科研或某些特殊实验中。
膦是一类通式为PH3−xRx的化合物,当x=0时,得到母体化合物磷化氢PH3。它是胺的同类物,也为三角锥构型,但由于磷原子半径较大的缘故,膦分子的键角比同类的胺要小,常用作过渡金属催催化剂的有机配体。
5)有机硅和有机硫等衍生物:
硅是C同族元素,所以SiR4, 只需在相应的烷烃前面加个硅字即可;
S则是O的同族元素,相应的ROH醇转化成RSH,命名为硫醇,-OH羟基对应的-SH,命名为巯基,CH3OCH3二甲基醚对应CH3SCH3,命名为二甲基硫醚。很简单对吧:)
4) 和 5) 这些主要是第三周期或者第四周期的非金属元素,大多是亲O(有时也亲F,如Si),Si-O, P=O等都具有很大的键能,意味着相应SiH4、PH3、SH等,很容易被氧化成相应的含氧化合物,一般为酸。比如RPO(OH)2磷酸,RSO3H磺酸(-SO3H磺酸基)等;其中硫的氧化物常见种类相对较多,比如CH3SCH3,二甲基硫醚氧化得到的CH3S(O)CH3,命名为二甲基亚砜,CH3(O)S(O)CH3,命名为二甲基砜。一般而言,这些基于非金属转化而得氧化产物,多以石为偏旁,右边表示音译的读音,如磺酸,砜等。
值得指出的是,这类非金属的H化物(很强的还原性),由于性质太过活泼,往往具有极强的毒性,接触时应特别小心;相应的后处理,就是用次氯酸钠等进行氧化处理得到相对稳定的氧化物,毒性就大大降低了。
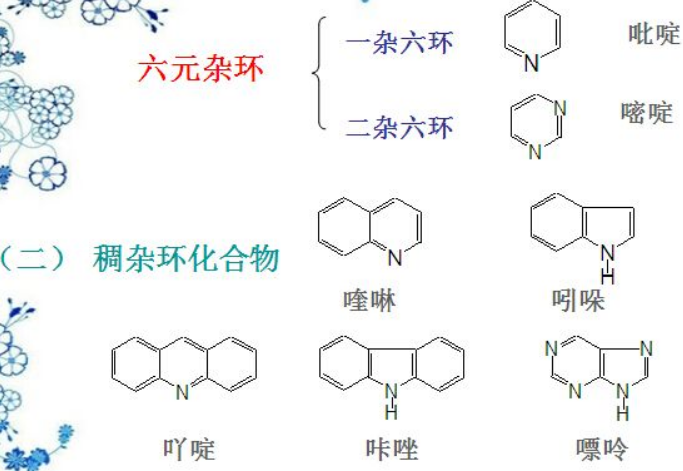
6)杂环化合物以及有机金属试剂等
首先先说有机金属试剂,本科学习,或者单独开章,或者归类于卤代烃下面,因为诸如RLi, R2CuLi和 RMgX( 研究生以后会学到RSnR3 Stille偶联的有机锡试剂;Suzuki偶联的有机硼试剂Rb(OH)2等),都可以从相应的卤代烃和金属交换而得到。本科里比较重要的是RMgX格式试剂和nBuLi等有机锂试剂。
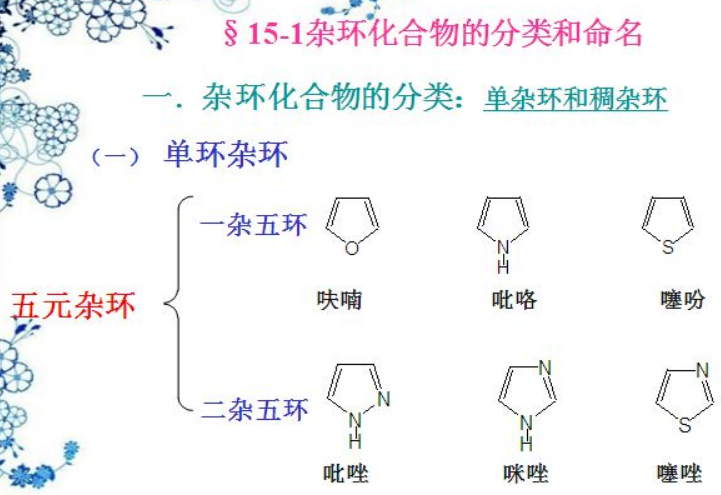
杂环化合物,望文生义,就是环状骨架上含有一个非C和H的杂原子,主要是O、S、N。除了冠醚之外,杂环化合物多以5,6的普通环为主,环多口杂,干脆以口为偏旁,右边汉字表示音译读音,一般为双字词:比如五元环的芳香杂环:呋喃(furan) 、噻吩(Thiophene)、吡咯(pyrrole);复杂点,如图吡唑(pyrazole)、咪唑(imidazole)和噻唑(thioazole)。
六元环的如:吡啶(Pyridine)、嘧啶(Pyrimidine)、吲哚(indole)和嘌呤(Purine)等;后面这些同学们在生物化学里常碰到,因为是DNA碱基对的重要组成部分(嘧啶和嘌呤)。
相应的,以上这些芳香性的杂环化合物,分子内含有多个双键,如何催化加氢把之还原之后,比如呋喃得到四氢呋喃(THF,常见有机溶剂)、吡咯还原得到四氢吡咯( Pyrrolidine)、以及吡啶还原得到的六氢吡啶(Piperidine)等;
比较有趣的是冠醚,因其形似皇冠而得名,可看作是多个乙二醇缩合聚集在一块,通式为 CH2CH2O
CH2CH2O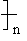 , n=5,6最为常见:前者分子骨架一共十五个原子,其中五个为O,所以叫做15-冠(醚)-5,括号内表示可以省略不写。15-冠-5分子大小正好匹配Na+、18-冠-6正好匹配K+,这样形成的稳定配位离子,从原先的水相,转移到了有机相,是很好的相转移催化剂(同季铵盐)。
, n=5,6最为常见:前者分子骨架一共十五个原子,其中五个为O,所以叫做15-冠(醚)-5,括号内表示可以省略不写。15-冠-5分子大小正好匹配Na+、18-冠-6正好匹配K+,这样形成的稳定配位离子,从原先的水相,转移到了有机相,是很好的相转移催化剂(同季铵盐)。
机理部分:
我们知道,化学反应的本质在于旧键的断裂和新键的生成。化学反应,就如同年轻男女的恋爱,分分合合,直到最后找到相对稳定的组合方式为止。什么样的组合才是相对稳定的呢?要么是平等互爱的共价键(H-H,C-H等电负性相差0-0.6),彼此付出差不多,追求的是精神上的契合;要么是完全依附的包养模式的离子键(比如NaCl, CaF2等,电负性相差1.8以上),单方面付出财富(电子),贪图的是享受。而介于这两种模式中间的(电负性相差0.6-1.8之间,极性共价键),要么抱怨对方付出的太少,要么难过于不被理解,感情总是处于容易被外界干扰的危险模式之中。
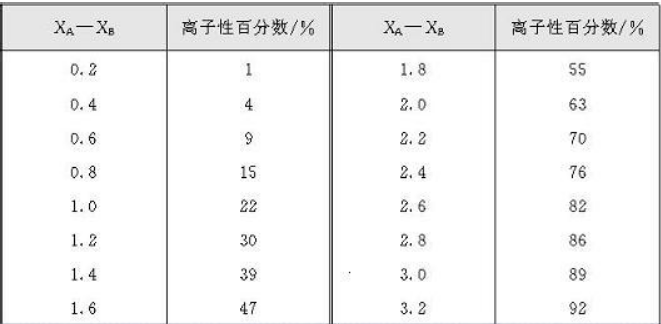
那么,什么是电负性呢?
先回顾一下八隅体规则:稀有气体如Ne(8)是最稳定的元素,对于C(4),N(5),O(6),F(7)都希望通过和其他原子成键共用电子,达到最外层满足Ne(8)八隅体的稳定结构,相应的需要形成8-4,8-4,8-6,8-7根化学键。和生活中类似,距离成功越近的人,往往有着越大的动力,而这样的人也就拥有最大的吸引力;我们把分子中原子吸引电子的能力定义为电负性。一般地电负性X>1.8的为非金属,电负性X<1.8的则为金属;1.8的硅、锗、锡则是脚踩两条船的骑墙派:半导体。
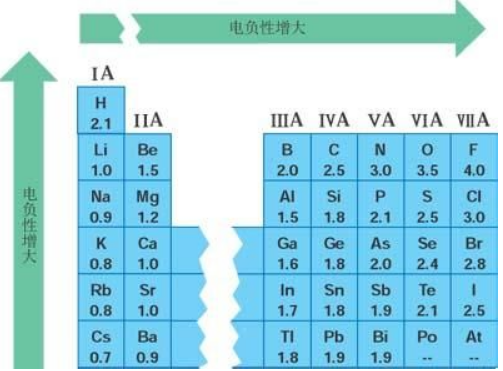
以第二周期元素为例:Li,Be,B,C,N,O,F为例,电负性从左到右依次变大;以VIIA卤素为例,F、Cl、Br、I、At,随着电子层数越多,原子核对于引进外来电子的渴望,受到自身电子的干扰,难免变得力不从心,从而电负性依次递减。这是高中元素周期律的基本知识。而大学有机,我们必须稍微延伸一点:电负性并不是孤立原子的性质,而与原子的化学环境有关。简言之,电负性取决于该原子对外来电子的吸引力,比如该原子带越多正电荷,那么对外来电子的吸引能力自然变大,于是电负性就变大(比如Fe3+(1.8)>Fe2+(1.7)。
稍微复杂点,由于钻穿效应(波函数的径向分布图):
1、同层轨道上的电子离原子核的平均距离相等(由主量子数决定);
2、角量子数小的电子在原子核附近有更多的机会出现,即离原子核越近,能量越低。
对于C来说,最外层的2s轨道比2p有更多的机会出现在原子核附近,所以2s轨道对外来电子的吸引力也就比2p轨道要来得大;自然地,对于sp、sp2、sp3杂化来说,这些杂化轨道里含有s的比例(1/2、1/3、1/4)越大,对外来电子的吸引能力就越大,也就是说,C电负性:sp杂化(接近于N、Cl)sp2>sp3。由于sp C-H的电负性相差0.9属于极性共价键,所以具有一定的酸性,在强碱作用下去除H+后生成相应的共轭碱。
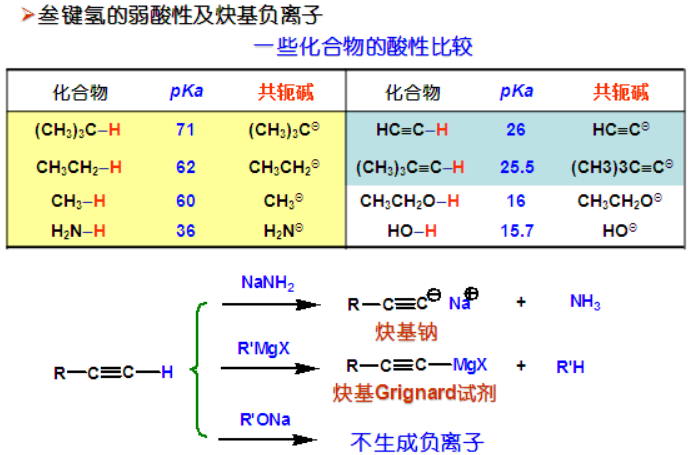
一段旧感情的破裂,无非两种情况:
1)小两口感情很稳定(电负性相差0-0.6,门当户对,情投意合),比如C-H,但基于不可抗拒的外力(总有人棒打鸳鸯),比如高温、光照或者自由基引发剂的作用下,在双方和平分手(先成键的一对电子,各自带走一个),恢复单身后,各自不得不重新寻找结婚对象去。
2)小两口感情原本就不稳定(电负性相差0.6-1.8,门不当户不对,三天两头怄气):
a)碳正离子:比如C-Cl,电负性小的C对于Cl一贯以来的霸道忍而再忍,但终有一天,在环境的刺激和亲友的支持下,把结婚时双方共同的财产全部留给Cl,忍痛离婚;全心全意付出的感情,最后只留下一颗破碎的心,该是多么急切地渴望能有个知心人可以托付。。。由于离婚赔给Cl一个电子,这时的C最外层只有3个电子(形成三对共价键,共6个电子),十分渴望能有一个电子富足的异性比如OH-,阴阳结合生成(CH3)3C-OH,于是琴瑟和谐。

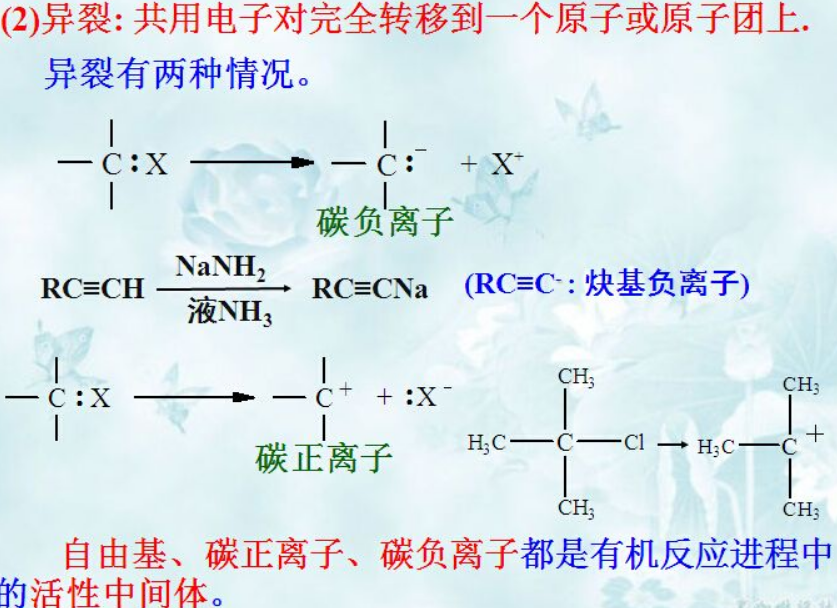
b)碳负离子:比如丙炔,由于sp杂化的 C电负性=3.0,比H的电负性超出0.9左右,这时的C成为了蛮横的一方,同a),H实在受不了这样的生活,终于在强碱如(NH2-)的诱惑下,毅然决然的把自己的电子留给C,跟着NH2-变成NH3跑了。留下的sp杂化的C,这时最外层虽然正好满足8个电子,但毕竟其中一个是从H那里敲诈而来的,不像F、Cl和O那样做惯了强盗,C怀揣横财,难免惴惴不安。这就像西方那些通过不正当手段敛得横财的富人,因于对原罪的恐惧,会投身于慈善,把自身一定量的财富(最外层的一对电子)和有需要的人(缺电子的碳正离子等)共享,于是化学的社会里又短暂获得了安定。
总体来说,有机机理主要就三种:碳正离子(自由基类同)、碳负离子和没有明显正负离子之分的协同反应(比如4+2 Diels-Alder 反应,3,3-重排反应等)。
卤代烃:
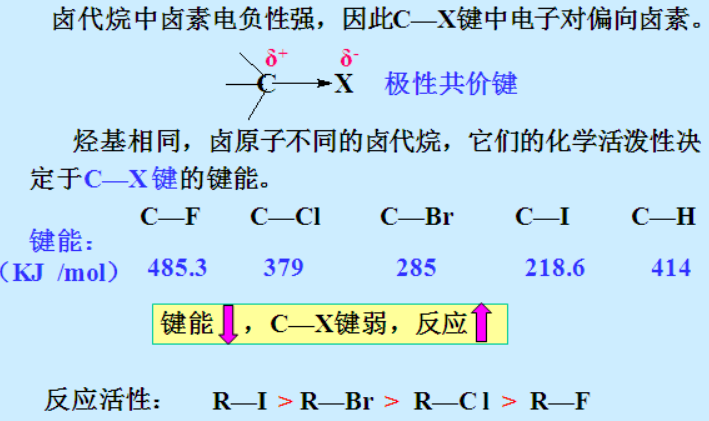
碳和卤素本来是为了组成美满的家庭(最外层8电子),各自付出了自己的感情(各提供一个电子),奈何碳慢慢发现了卤素过于自私自利(把电子云都拉向了自己),感情缺乏长期坚持的基础,或早或晚,终将破裂(所以C-X键不稳定):决裂的速度,首先取决于卤素的负心程度,Cl<Br<I, 而F由于占有欲实在太强(大于稳定的C-H键这样美满的婚姻),碳是无法脱身的,人生悲哀,莫过于此。
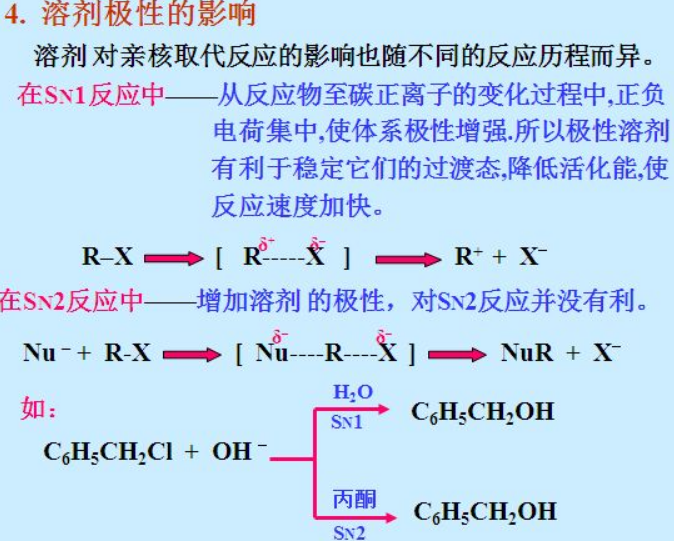
C-X分手的速度,和环境(溶剂)是有密切关系的:强极性溶剂就像周围有一群非常热心肠的同学和朋友,能够抚慰C被X卷走一对电子后所受到的伤痛,有利于C主动选择放弃不良伴侣X,勇敢地单飞成为碳正离子,这样单方面做出的选择,也就是单分子反应历程。
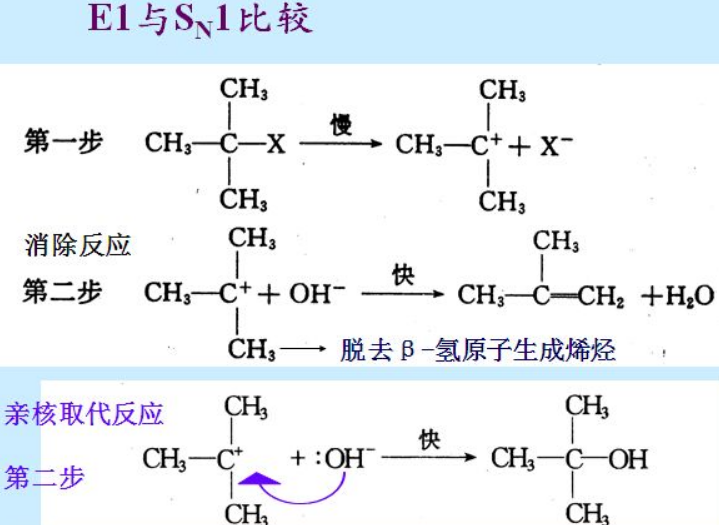
NaOH/H2O这样的高帅富(愿意分享电子,并且自身毛病不多(空间位阻小),也就是亲核性相对大于碱性的体系,有利于SN1,即C+重新组成了幸福的家庭;而NaOR/ROH这样钱多,愿意接收单亲家庭的孩子H+,但却无心和C组成家庭的情况下(碱性大于亲核性),C+这样的单身母亲,只好割舍下抚养不起的孩子H+,消除掉负担重新成为自由人(烯烃),有利于E1。
C是否能够勇敢地选择单飞,更取决于C上的取代基,这些取代基,就是C的亲人,如果亲人很多(比如叔丁基,3级),则伤痛容易得到抚慰,就容易做出分手的决定,C-X破裂,让X-滚蛋;然后有幸碰到良人Nu(愿意共享电子,且个头比较小)就选择SN1,不幸只能碰到只愿意领养孩子(H+)的,就忍痛消除,选择E1,一切重新来过。

而如果对于非极性溶剂,也就是缺乏周遭环境的支持,没有同学好友的抚慰,C就很难有足够的勇气去主动放弃X;同样的C上烷基取代这样的亲人的支持越少,比如只有一个亲人的话(一级卤代烃),考虑到亲人单飞的痛苦经历,就更难有勇气去主动舍弃X;在这样的情况下,就需要有第三方的协助,比如一个高帅富的Nu来主动追求,时间推移,在C的心目中,Nu和X就摆在天平的两端,自身不偏不倚的情况下(sp2杂化,平面垂直于Nu-C和C-X),最终权衡出Nu更值得依靠,于是把X放弃掉,这样的情况下,也就是放弃X,需要Nu的大力协助,所以是SN2双分子取代历程;对于Nu来说,初期接触C,必须在X的背后下手,趁虚而入,对C受伤的心灵,嘘寒问暖,才可以慢慢让C把它的重要性提高到可以和X竞争的水平上。所以SN2反应,Nu要从背面进攻,立体构型会翻转(瓦尔登翻转)
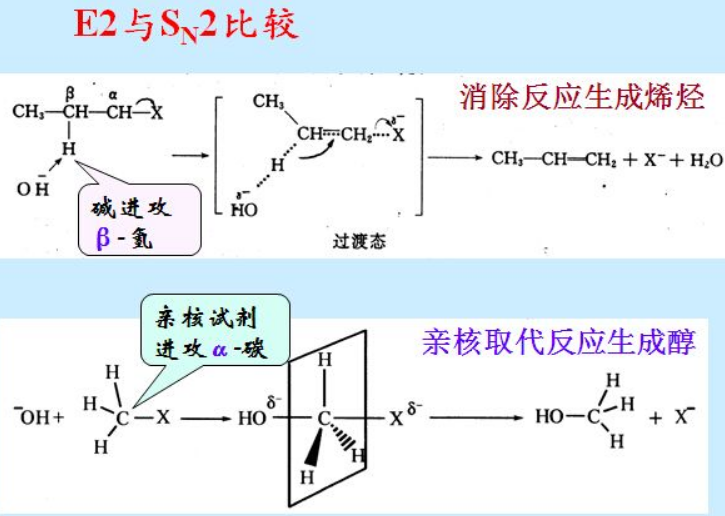
这时候,如果C没能碰到良人,只碰到了愿意接收她的孩子(H+),考虑到现实中破碎的家庭,强撑着不离婚,无非是因为孩子的牵绊;现在发现有了一个碱来接收自家的孩子,承诺带给孩子幸福,C也就放下了包袱,让X灰溜溜带着电子滚蛋去,自己重新恢复自由身,成为烯烃,这种时候,需要有一个碱来主动接收孩子H+的消除反应,就是E2消除。
简单总结一下:
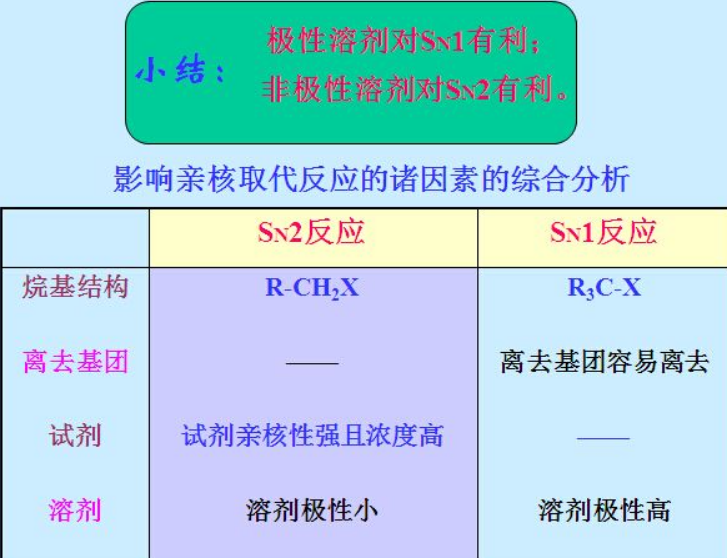
强极性溶剂,如H2O,温馨的环境很好地抚慰了C+受伤的心灵(同理,HCl气态是共价键,到H2O里,就电离成H3O+和Cl-了),C+容易获得稳定,也就容易生成,有利于单分子历程;亲核性强且个头小的Nu容易发生SN1单分子亲核取代; 碱性强且个头大的易于发生E1单分子消除。
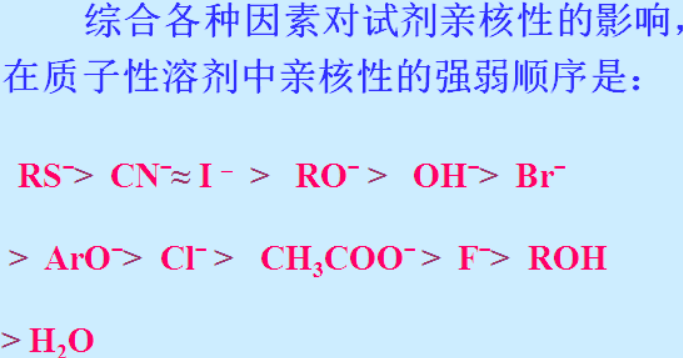
弱极性溶剂下,C+缺乏极性溶剂分子的稳定作用,不稳定也就不容易生成,这时必须得有外来第三者的强势介入,C-X才会断裂:亲核性强且个头小的Nu, 从C-X键的背后趁虚而入,发生双分子历程的亲核取代反应,SN2,手性构型翻转;个头大亲核性差的的碱,在X的背后看不到的情况下趁虚而入收留了β-H,让C消除了包袱,于是C有了足够的底气,让X带着一对电子滚蛋。考试喜欢考的是,1级R,亲核性强的Nu,SN2;3级R, 亲核性强的Nu, SN1; 个头大的碱,E1; 烯丙基或者苄基,由于自身很稳定,所以很容易生成,什么反应都有利,主要取决于环境;乙烯式卤代烃,C-X键很难断裂,什么反应都很难进行。

- 全部评论(0)
