浅谈物质热稳定性的比较
时间:2022-05-20 09:52 来源:未知 作者:郭树丰 点击: 次 所属专题: 稳定性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、问题提出
热稳定性是物质的重要性质之一。在中学阶段,通过实验设计验证物质热稳定性的强弱,一般从2个方面考虑:
一是控制相同的温度,通过实验现象比较物质发生热分解的难易或快慢;
二是测量在相同时间内物质发生相同程度的热分解所需要的不同温度。
2种方法相比较,第一种方法比较容易操作。中学阶段,对物质热稳定性强弱的解释或推测,有2种常见的思路:一种是通过比较元素金属性或非金属性的强弱来得出结论;另一种是通过比较反应物在发生热分解反应时所断裂的化学键的强弱来得出结论。这2种思路虽然都能够解释一些现象和问题,也能够用来推测一些物质热稳定性的强弱,但都忽视了生成物的结构和性质对物质热稳定性的影响,论证不够严密充分,有时甚至会推出一些与事实不符的结论。本文拟从中学阶段常见物质热稳定性强弱的比较入手,综合考虑热力学和动力学因素,探讨比较物质热稳定性强弱的一般规律和方法。
2、分析讨论
决定物质热稳定性强弱的本质因素是物质及其分解产物的结构。因为物质结构决定了物质的性质。从热力学的角度分析,反应物和生成物的结构决定了反应的吉布斯自由能变(ΔG=ΔH一T ΔS)的大小。所示反应的ΔG越小,反应的热力学趋势就越大;从动力学的角度分析,反应物和生成物的结构决定了反应历程,而不同的反应历程具有不同的活化能,从而导致了热分解反应的难易程度有所不同。由于本文基本没有涉及不同温度下物质的热分解产物可能不同的问题,所举例子基本属于反应物和分解产物相似(即反应历程相似)的情况,故本文论证时主要考虑热力学因素,通过热力学有关理论基本可以推测中学阶段常见物质热稳定性的强弱。
2.1卤化氢(HX)
卤化氢(HX)的分解通式可以表示为2HX=H2+X2(g),查阅有关物质的热力学数据,根据热力学有关公式,可以计算卤化氢分解反应的 ΔH、ΔS和ΔG,计算结果示于表1,从表1可以看出,从上到下对应的卤化氢(HX)分解反应的ΔG逐渐减小,可推测卤化氢(HX)的热稳定性逐渐减弱。
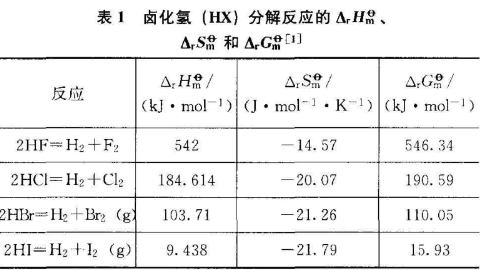
另外,还有一种近似分析方法,考虑到卤化氢(HX)的热分解反应是一类气体的物质的量不变的反应,可粗略认为卤化氢(HX)热分解的ΔS基本相同,ΔG的大小主要由ΔH大小决定。忽略分子间的相互作用,ΔH可由反应物和生成物的键能数据粗略计算。有关反应由键能得到的ΔH示于表2。从表2中可看出,从上向下对应的反应的焓变逐渐减小,即卤化氢(HX)热分解反应的ΔG逐渐减小,则其热稳定性逐渐减弱。

从反应历程分析,卤化氢(HX)热分解反应的历程简单,自由原子H和X比较容易结合成H和X,则H-X键断裂后,即可认为分解反应已经发生,故根据H-X键能大小推测和根据ΔG大小推测可得到一致的结论。
2.2NH3与CH4
关于NH3与CH4热稳定性强弱的比较,一般有2种不同的观点:一种观点认为,氮元素的非金属性比碳元素强,因而NH4比CH4稳定;另一种观点认为,CH4的正四面体型结构比NH3的三角锥形结构稳定。笔者认为2种观点都缺乏充分的论证。
NH3分解的方式为2NH3=N2+3H2;CH4分解有2种方式:CH4=C(s)+2H,2CH4=C2H2+3H2。查阅有关物质的热力学数据,根据热力学有关公式,可以计算NH3与CH4分解反应的ΔH、ΔS和ΔG,计算结果示于表3.
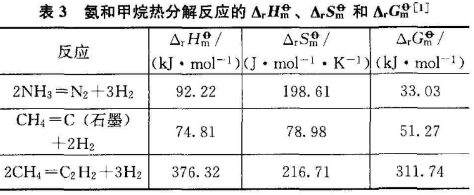
从表3可知,NH3的热稳定性比CH4弱。CH4的第一种分解方式与NH3的分解方式相似,和CH4的第一种分解方式相比,CH4的第二种分解方式较难进行,因此判断CH4的热稳定性强弱应考虑第一种分解方式。查阅有关数据可知,在没有催化剂的情况下,NH3在800℃左右可以分解,而CH4的第一种分解方式需要1000℃左右的高温,第二种分解方式需要1200℃左右的高温。
从结构的角度分析,NH3与CH4中的N和C都采取了sp3杂化,但由于N原子中孤对电子的影响,导致N-H键能(391kJ·mol-1)小于C—H键能(413kJ·mol-1),也是NH3比CH4热稳定性弱的重要原因。
2.3卤化铵(NH4X)
卤化铵热分解反应的通式为:NH4X(s)= NH3+HX,关于卤化铵热稳定性的比较,有人认为,可通过比较NH4+与X-离子键的强弱来确定随着原子序数的逐渐增大,X-离子半径逐渐增大,NH4+才与X-离子键的强度逐渐减小,从而导致卤化铵的热稳定性逐渐减弱:NH4F>NH4Cl> NH4Br>NH4I。笔者认为,上述推测没有考虑卤化铵热分解反应的实际反应历程,推测结果是错误的。
从反应历程的角度分析,卤化铵热分解反应的实际是NH4F中N-H键的断裂和H-X键的生成,即NH4+中的H+发生转移并与X-结合。实际反应不经过熔融态即可发生(参考NH4Cl热分解反应的实验现象),故可推测,X接受H的能力越强,则对应的卤化铵就越容易分解。而X与H结合能力的强弱,可通过HX的ΔH值或H-X的键能大小来判断。查阅HX的ΔH,可推测卤化铵的热稳定性随X结合H能力的减弱而逐渐增强,即热稳定性顺序为:NH4F<NH4Cl<NH4Br<NH4I。
同理,可以推测出(NH4)2CO3比NH4HCO3易发生热分解;(NH4)2S比NH4Hs易发生热分解;(NH4)3PO4发生热分解温度最低(40℃),(NH4 )2 HPO4 居中(140℃),NH4 H2PO3最高(170℃)。
需要指出的是,在热分解反应中酸根离子与H结合能力的强弱,不能用弱酸的电离常数来分析。因为电离常数是描述酸根离子在水溶液中接受H的能力倾向。如(NH4)2CO3和(NH4)2PO4比较:虽然PO43-在水溶液中接受H的能力比CO32-强,但综合考虑(NH4)2CO3热分解和(NH4)3PO4热分解有关的热力学数据,可推测出(NH4)2CO3比(NH4)3PO4易发生热分解反应,推测结果与实验结果相符。
2.4NaHCO3与Na2CO3
160℃时,NaHCO3能够发生热分解反应:2NaHCO3=Na2CO3+CO2+H2O(g);在中学教材中对NaCO3的热稳定性表述为:在酒精灯加热的条件下不能发生热分解反应。研究发现Na2CO3热分解需要1000℃以上的高温,反应为Na2CO3=Na2O+CO2
查阅2种分解反应中相关物质的热力学数据根据热力学公式,可计算出NaHCO3与Na2CO3分解反应的ΔH、ΔS和ΔG,计算结果示于表4,从计算结果可知,NaHCO3比Na3CO3更容易发生热分解,与实验结果相符。
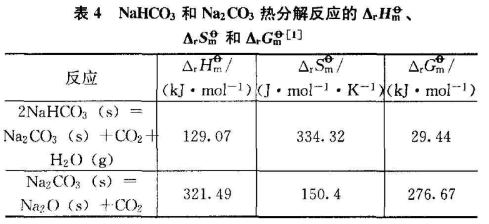
从反应历程的角度分析,NaHCO3热分解的本质是HCO3-中一个H-O键和一个C-O键的断裂,由于有水生成,所以反应不需经过熔融态即可发生;而Na2CO3的热分解必须经过熔融态破坏离子键,然后CO32-中的2个C-O键发生断裂。2者比较,显然NaHCO3比Na2CO3更容易发生热分解。另外,HCO3-中的C-O键与CO32-中的C-O键强度有一定差别,这也是导致NaHCO3容易发生热分解的因素。
同理,可推测物质的热稳定性:H2CO3<NaHCO3;H2SO3<NaHSO3<Na2SO3;H2SiO3<NaHSIO3<Na2SiO3等。
2.5Na2CO3与Na2SiO3
实验证明:Na2CO3在酒精灯加热的条件下不发生分解,其分解温度大约在1000℃以上,而NaSiO3则“不”能发生分解。
从反应历程的角度分析,反应开始于Na2CO3和Na2SiO3的熔融及C-O键和Si-O键的断裂,且都生成Na2O。查阅有关数据甲发现,晶格能U(Na2CO3)>U(Na2SiO3),而键能E(C-O)<E(Si-O).从表面分析这2组数据,可能得出 2种不同的结论。实际上,这2组数据均相差不大,说明2者均不是造成Na2CO3和Na2SiO3热稳定性差异较大的主要因素。因此我们可以推测,Na2CO3与Na2SiO3的热稳定性主要取决于2者分解的不同产物CO2与SiO2。
从热力学的角度分析,Na2CO3与Na3SiO3热分解的ΔH相差不大,但NaCO3分解生成CO2气体,反应后熵值增加较大(ΔS>0)。而Na2SiO3分解的ΔS不大,因而导致Na2CO3 比Na2SiO3易发生热分解。由此我们不难理解工业上制玻璃时Na2CO3、CaCO3与SiO2。反应的实质,也可以用类似的思路来推测H2CO3与H2SiO3、H2SO3与H2SO4、H2SO4与H3PO4以及Na2CO3、Na2SO4、Na3PO4的热稳定性强弱,它们是熵驱动反应的典型实例。
2.6MgCO3与CaCO3
MCO3热分解的热力学循环如下:
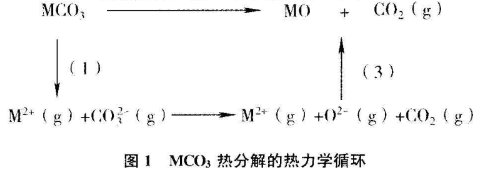
由图1可见,2者分解的过程(2)完全相同,可不必考虑过程的差别,2者分解的ΔS基本相同,差值也可忽略不计。因而2者发生热分解反应的ΔG二主要由ΔH二决定,而ΔH的大小主要由晶格能【U(MCO3)和U(MO)】决定。MgCO3与CaCO3、MgO与CaO晶格类型相同,故可推测晶格能相对大小:U(MgCO3)>U(CaCO3)、U(MgO)>U(CaO).查阅有关晶格能数据:U(MgCO3)=3180kJ·mol-1,U(CaCO3)=2840kJ·mol-1,U(MgO)=3929kJ·mol-1,U(CaO)=3477kJ·mol-1,经计算可知,MgCO3比CaCO3易发生热分解。
从结构的角度分析,考虑到CO32-半径比O2-大许多,则U(MCO3)比U(MO)小许多。虽然CaCO3比MgCO3容易熔化,但由于MgO比CaO更稳定,从而导致MgCO3比CaCO3易发生热分解。同理,可比较出Na2CO3与K2CO3热稳定性的强弱。
3、结论
通过以上分析可以看出,比较物质的热稳定性强弱,理论上应综合考虑热力学因素(ΔG)和动力学因素(反应历程和活化能),在实际推测过程中,某些影响不大的因素可以忽略不计,关键是要抓住主要的影响因素。
需要说明的是,目前资料提供的热分解温度,有的是物质开始分解的温度,有的是物质分解完全的温度,也有的是物质分解达到一定程度的温度,目前还缺乏一个统一的标准。在引用这方面数据的时候,要注意到这一差别,根据具体情况加以分析。
参考文献
【1】邵学俊等。无机化学(上册).第2版。武汉:武汉大学出版社,2002:附录
【2】刘春阳。等离子体催化氨气裂解制氢的研究。大连理工大学工业催化(专业)硕士论文,2006
【3】邵学俊等。无机化学(下册).第2版。武汉:武汉大学出版社,2003:207
【4】北京师范大学无机化学教研室等编。无机化学(上册).第4版。北京:高等教育出版社,2003:154
【5】吴孙富,张道林。化学教育,2008,29(5):74

- 全部评论(0)
