杂化轨道的判断
时间:2023-01-10 10:01 来源:未知 作者:化学自习室 点击: 次 所属专题: 杂化类型判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、基本方法
最基本的常规方法,是根据VSEPR判断。由于Vp(价层电子对数)=Lp(孤电子对数)+ Bp(σ键电子对数),而杂化轨道要么用来容纳孤电子对(Lp),要么填充1个电子用来形成σ键(Bp)。因此杂化轨道数就等于Vp数。
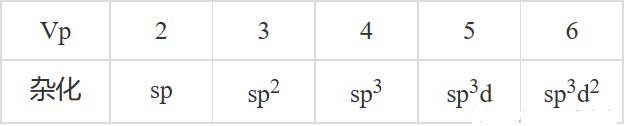
(中学教材只涉及了s、p轨道的杂化,尽管近年高考出现了d轨道参与的杂化,但判断依据不变)
二、π键法
对于C、N、O三种原子(注意仅适用于这三种原子,甚至不能推广到其所在的族),还可以通过其所成π键数来判断。对于sp、sp2杂化来说,未杂化的p轨道通常要用于形成π键,所以中心原子所成的π键数就是其未杂化的p轨道数。因此可用sp3-π键数来判断。
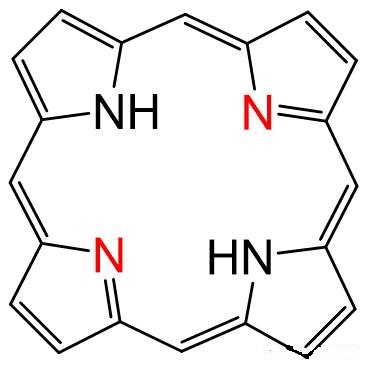
(根据此法,可判断卟啉环中红色N为sp2杂化)
为什么B原子不能用这个方法判断呢?BF3就是一个典型的例子,计算其Vp=3,应为sp2杂化。但在其常规结构式中却看不到π键:
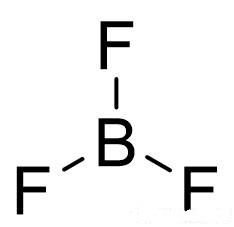
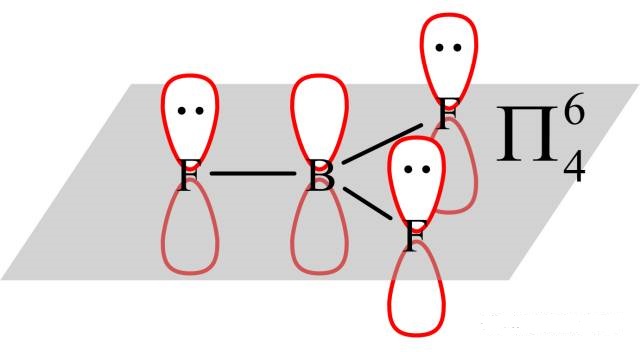
这是由于B的空p轨道参与形成了大π键:
为什么不能推广到同族原子呢?因为周期数≥3的主族原子有空的d轨道,可以使用d轨道形成π键。比如SOCl2:
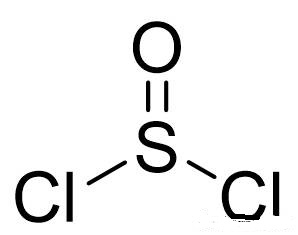
中心S原子的Vp=4,应为sp3杂化。而在结构式中可以看到S跟O形成了π键,这就是由S的d轨道和O的p轨道形成的d-pπ键,而且事实上有两条。只是这两条d-pπ键的键能和一条普通p-pπ键的键能相仿,所以通常在S、O之间画成双键。这部分内容超纲了,仅作解释,不作要求。
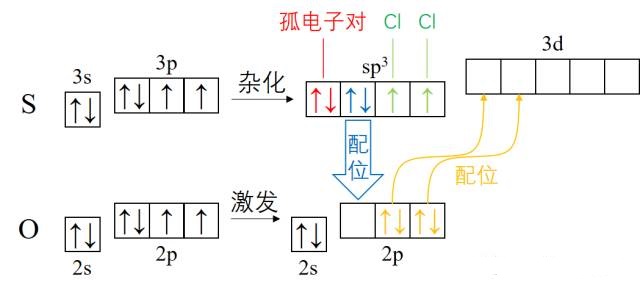
成键示意图
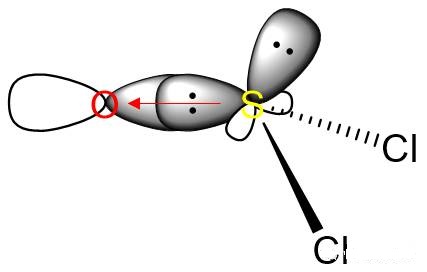
S的sp3杂化轨道与S→O σ配位键
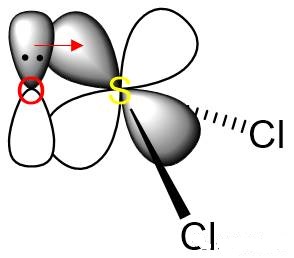
O→S d-pπ键(一条)
sp3杂化的主族中心原子(周期数≥3),若其在结构式中有π键,则皆属此类。如磷酸、硫酸等:
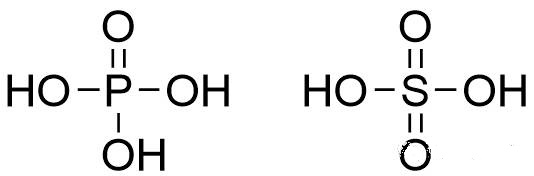
三、特殊杂化
无法用以上方式判断的杂化即为特殊杂化,最典型的例子是吡咯:
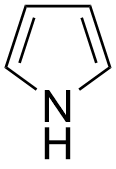
使用方法二判断:C原子均成一条π键,是sp2杂化(这一点正确);N原子不成π键,是sp3杂化(这一点错误)。
实验测定吡咯是一个平面分子,因此N原子只能是sp2杂化:
所以,正经出题的时候,都应该这么问:已知吡咯为平面分子,则吡咯中N原子的杂化方式为?毕竟成了平面分子,也就只有sp2杂化能满足了。
而前面的这个分子:

左上和右下的两个黑色N原子其实也相当于在吡咯环中,同样是sp2杂化。右下的环虽然看起来跟吡咯有些差别,但由于所有的C原子都是sp2杂化,所以跟左上角的环并无区别,只是画成单双交替的结构,画到它这儿只能画成这样了。
类似的情况还有:尿素中的N、苯酚中的O等等。
(尿素共面)

- 全部评论(0)
