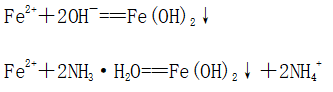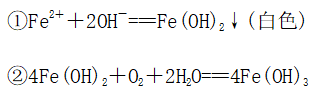铁及其化合物性质知识点总结
时间:2023-08-13 19:14 来源:未知 作者:化学自习室 点击: 次 所属专题: 铁及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、单质铁1、铁元素的存在
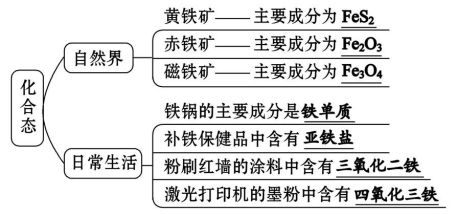
(1)游离态:存在于陨铁中
(2)化合态
2、铁的原子结构
(1)电子排布式:
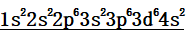
①最高能级电子数6
②最高能层电子数2
③未成对电子数4
④稳定性:Fe2+<Fe3+
(2)微粒结构示意图
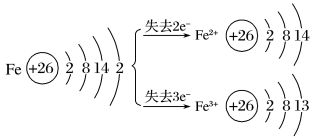
(3)周期表中位置:第4周期第Ⅷ族
二、铁的物理性质
铁的物理性质:
铁是一种有金属光泽的银白色金属,有良好的导热性和延展性。铁能导电,但其导电性不如铜和铝。
密度是7.68g·cm-3,熔点是1535℃,沸点是2750℃,粉末为黑色。
铁属于重金属、黑色金属、常见金属。铁能被磁铁吸引
三、铁的化学性质
铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物,且Fe3+比Fe2+稳定。
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应
(1)铁与氧化性较弱的氧化剂
(如:盐酸、硫酸铜溶液等)反应,铁原子失去2个电子生成+2价铁的化合物
(2)铁与氧化性较强的氧化剂
(如:氯气、硝酸等)反应,铁原子则失去3个电子生成+3价铁的化合物
1、Fe与非金属反应
(1)Fe与O2的反应:
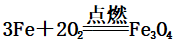
(火星四射、剧烈燃烧、放出大量的热、生成黑色的固体)
(2)Fe在氯气中燃烧:
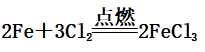
(产生棕黄色的烟)
(3)Fe与硫的反应:
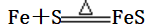
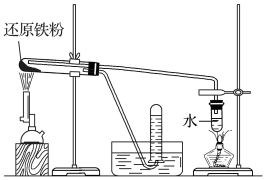
2、Fe与水蒸气的反应
装置Ⅰ | 装置Ⅱ | |
实验装置 |
|
|
操作及现象 | 用小试管收集一试管气体,点燃,听到轻微的“噗”声,证明生成了氢气 | 用火柴点燃肥皂泡,听到爆鸣声,证明生成了氢气 |
实验结论 | 红热的铁能与水蒸气反应,化学方程式:
| |
注意:
①铁与水蒸气的反应实验中,湿棉花的作用是加热时可产生水蒸气,与铁粉反应生成氢气②铁与水蒸气反应,日常生活中能用铁壶烧水是因为铁只能在高温下与水蒸气反应,与冷水、热水都不能反应
③常温下,铁与水不起反应,但在水和空气里的O2等共同作用下,铁易被腐蚀
3、Fe与酸的反应
(1)与非氧化性酸(如:稀盐酸、稀硫酸)的反应:
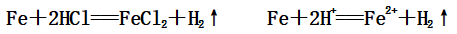
(2)与氧化性酸(如:硝酸、浓硫酸)的反应
注意:
常温下,铁遇冷的浓硫酸、浓硝酸产生钝化现象,即:浓硫酸、浓硝酸将铁的表面氧化成一层致密的氧化物薄膜,这层莫阻止了酸与内层金属的进一步反应。但在加热的条件下铁可以和浓硫酸、浓硝酸反应
①少量的铁与稀硝酸反应:
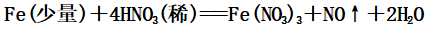
生成的Fe(NO3)3可以和铁继续反应:
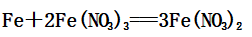
②过量的铁与稀硝酸反应:
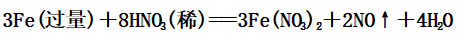
③少量的铁与浓硝酸共热:
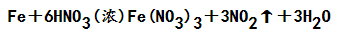
4、与盐溶液反应:
(1)与硫酸铜溶液的反应:

(2)与FeCl3溶液的反应:
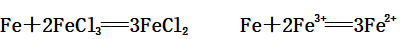
四、铁的冶炼
工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来
1、设备:炼铁高炉
2、原料:铁矿石、焦炭、空气、石灰石等
3、主要反应
(1)还原剂的生成
①生成CO2:

②生成CO:

(2)铁的生成:

(3)炉渣的形成
①
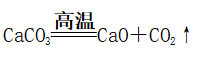
②

五、铁的氧化物

六、铁的氧化物化学性质
1、稳定性
(1)FeO不稳定,在空气中受热易被氧化为Fe3O4:
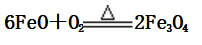
(2)Fe2O3和四氧化三铁很稳定
2、与非氧化性酸(如:稀盐酸、稀硫酸)的反应
氧化亚铁和氧化铁属于碱性氧化物,与非强氧化性酸反应生成Fe2+和Fe3+
(1)FeO与盐酸反应:
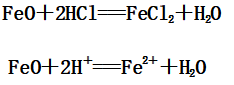
(2)Fe2O3与盐酸反应:
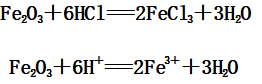
(3)Fe3O4与盐酸反应:
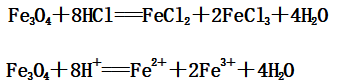
3、与氧化性酸(如:硝酸、浓硫酸)的反应
(1)FeO与稀硝酸反应:
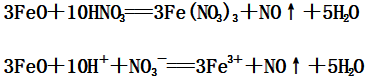
(2)Fe2O3与稀硝酸反应:
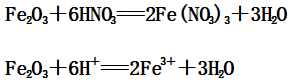
(3)Fe3O4与稀硝酸反应:
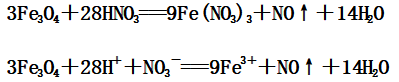
4、与还原性酸(如:HI)的反应
(1)FeO与HI反应:
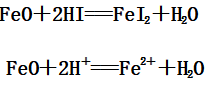
(2)Fe2O3与HI反应:
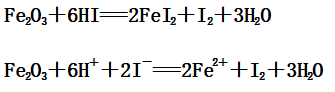
(3)Fe3O4与HI反应:
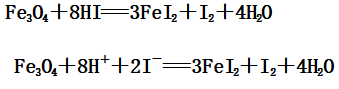
七、铁的氧化物主要用途:
氧化铁俗称铁红,常用作红色油漆和涂料,赤铁矿(主要成分是Fe2O3)是炼铁原料
八、铁的氧化物易错考点
1、化合态铁的常见化合价只有+2价和+3价,Fe3O4是黑色具有磁性的晶体,可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式,因此Fe3O4与盐酸反应可分别看作Fe2O3、FeO与盐酸反应,然后把两个反应式相加
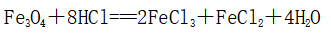
2、FeO、Fe2O3属于碱性氧化物,Fe3O4不属于碱性氧化物
3、从价态分析,FeO有还原性,Fe2O3有氧化性,Fe3O4既有氧化性又有还原性。但FeO与Fe2O3中Fe元素价态相邻,两者不会反应。FeO、Fe3O4遇氧化性酸(如:HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价
4、FeO和Fe3O4与HNO3反应时,除考虑与H+的反应外,还考虑Fe2+被HNO3氧化成Fe3+。
5、Fe2O3、Fe3O4、Fe(OH)3与HI反应时除考虑与H+的反应外,还考虑Fe3+被I-还原为Fe2+。
九、确定铁的氧化物组成的基本方法
设铁的氧化物中铁元素与氧元素的质量比为M∶N,
则氧化物中
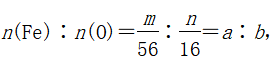
若a∶b=1∶1,则铁的氧化物为FeO;
若a∶b=2∶3,则铁的氧化物为Fe2O3;
若a∶b=3∶4,则铁的氧化物是Fe3O4或FeO与Fe2O3按物质的量之比为1∶1的混合物或FeO、Fe2O3、Fe3O4的混合物(其中FeO、Fe2O3物质的量之比为1∶1,Fe3O4为任意值)。
十、铁的氢氧化物物理性质比较
氢氧化物 性质比较 | Fe(OH)2 | Fe(OH)3 |
物质类别 | 二元弱碱 | 三元弱碱 |
颜色状态 | 白色固体 | 红褐色固体 |
铁的价态 | +2 | +3 |
溶解性 | 难溶于水 | |
十一、铁的氢氧化物化学性质
1、与非氧化性酸(如:稀盐酸、稀硫酸)的反应
(1)Fe(OH)2与盐酸反应:
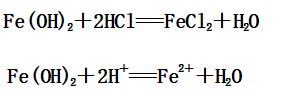
(2)Fe(OH)3与盐酸反应:
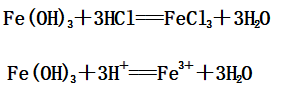
2、与氧化性酸(如:硝酸、浓硫酸)的反应
(1)Fe(OH)2与稀硝酸反应:
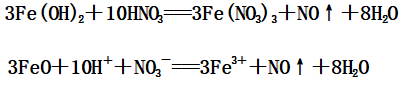
(2)Fe(OH)3与稀硝酸反应:
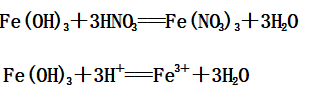
3、与还原性酸(如:HI)的反应
(1)Fe(OH)2与HI反应:
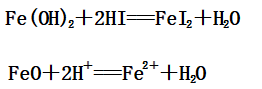
(2)Fe(OH)3与HI反应:
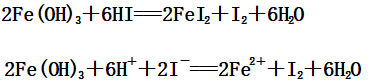
4、热稳定性:
Fe(OH)2、Fe(OH)3受热均分解生成同价态的氧化物
(1)Fe(OH)2:
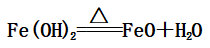
(隔绝空气生成FeO,在空气中最终转化为Fe2O3)
(2)Fe(OH)3:
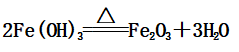
5、Fe(OH)2的还原性:
Fe(OH)2具有强还原性,易被空气中的O2氧化生成Fe(OH)3
(1)转化过程中的特殊现象是:白色沉淀迅速变成灰绿色,最终变成红褐色
(2)转化的方程式:
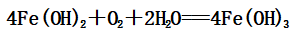
(3)反应类型:化合反应、氧化还原反应
注意:
①Fe(OH)2在空气中加热,在分解同时被O2氧化,化学方程式为:
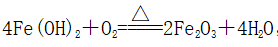 ,
,
所以在空气中加热Fe(OH)2得不到FeO
②Fe(OH)2中的Fe为+2价,处于中间价态,既有氧化性又有还原性,但以还原性为主,与HNO3、浓硫酸等强氧化性酸发生的氧化还原反应而不是复分解反应
③Fe(OH)3中的铁为+3价,处于最高价态,只有氧化性,与HNO3、浓硫酸等强氧化性酸时发生的是复分解反应而不能发生氧化还原反应,但与氢碘酸(HI,I—有还原性)反应时则发生氧化还原反应
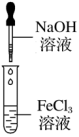
十二、氢氧化铁的制备
实验原理 | 可溶性铁盐[FeCl3、Fe2(SO4)3、Fe(NO3)3]与碱(强碱或弱碱)反应 | 实验装置 |
| ||
实验操作 | ①将NaOH溶液滴入FeCl3溶液中:Fe3++3OH-===Fe(OH)3↓ ②将氨水滴入Fe2(SO4)3溶液中:Fe3++3NH3·H2O===Fe(OH)3↓+3NH4+ | |
实验现象 | 有红褐色沉淀生成 | |
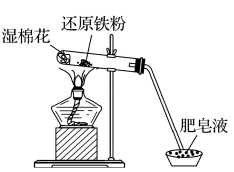
十三、氢氧化亚铁的制备
Fe(OH)2易被空气中的氧气氧化,生成Fe(OH)3,所以在制备Fe(OH)2时:
1、要确保Fe2+溶液中无Fe3+,故需加Fe粉,把Fe3+转化为Fe2+。
2、要尽量减少与O2的接触,故采取加热的方法赶走所需溶液中溶解的O2,冷却后再反应;同时应防 止空气中的O2再溶于溶液,常用的方法有三种:
止空气中的O2再溶于溶液,常用的方法有三种:
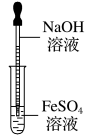
(1)反应在试管底部进行。
如图甲,这是中学阶段唯一把胶头滴管插入反应溶液的实验。
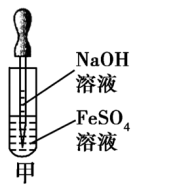
实验原理 | 可溶性铁盐[FeCl2、FeSO4、Fe(NO3)2]与碱(强碱或弱碱)反应
| 实验装置 |
| ||
实验操作 | 将吸有NaOH溶液的胶头滴管插入新制备的亚铁盐溶液的液面以下,缓缓挤出NaOH溶液 | |
实验现象 | 白色沉淀生成,迅速变成灰绿色,最后变成红褐色 | |
化学方程式 |
| |
注意:
①Fe2+极易被氧化,所以FeSO4溶液要现用现配,并放入少量的铁粉以防止Fe2+被氧化成Fe3+
②为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2
③为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液,这样做的目的是防止生成的Fe(OH)2与空气中的氧气接触而被氧化
④为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油、苯或其他密度小于水而不溶于水的有机物,以隔绝空气
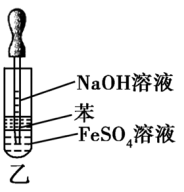
(2)加隔氧剂,如加入汽油、苯等比水轻的有机溶剂。
如图乙,由于苯的液封作用,防止了生成的Fe(OH)2被氧化,因而可较长时间观察到白色的Fe(OH )2沉淀。
)2沉淀。
(3)利用反应产生非氧化性气体(或通入非氧化性气体)赶走空气的方法。
如方案一、方案二,此方法可以长时间观察到白色的Fe(OH)2沉淀。
方案一:
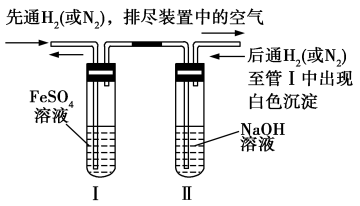
该方法是先用非氧化性气体排尽溶液和装置内的空气,再把试管Ⅱ中的NaOH溶液压入试管Ⅰ中反应。
方案二:
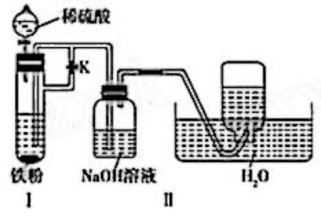
该方法是先在装置Ⅰ中产生FeSO4溶液,并利用产生的H2排尽两溶液和装置内的空气,再关闭止水夹K,利用产生的H2把FeSO4溶液压入装置Ⅱ的NaOH溶液中。
十四、亚铁盐的性质及应用
1、弱氧化性
(1)Mg、Al、Zn与亚铁盐溶液发生置换反应
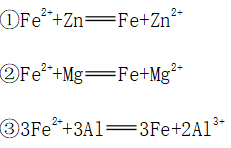
(2)K、Ca、Na与亚铁盐溶液反应
①先与水反应:
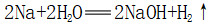
②碱与亚铁盐反应:
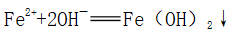
2、强还原性
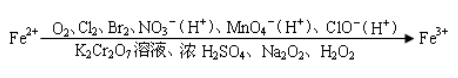
(1)能够被Cl2、Br2氧化
①除FeCl3溶液中的FeCl2溶液:
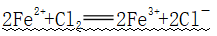
②Br2:
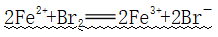
(2)能够被O2氧化
①反应:
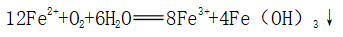
②保存:密封保存,防止O2将Fe2+氧化;加少量铁将Fe3+还原成Fe2+
③一般现用现配,不能长期保存
(3)能够被酸性的H2O2氧化
①反应:
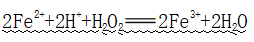
②应用:除去Fe3+中Fe2+的最佳方法
(4)与酸性条件下的MnO4-、NO3-、ClO-等离子不能大量共存
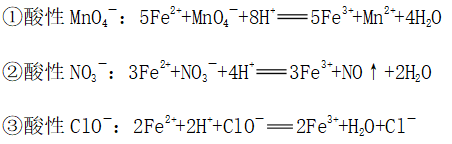
(5)还原性:I->Fe2+>Br-
①向FeBr2溶液通入Cl2,先氧化Fe2+,后氧化Br-
②向FeI2溶液通入Cl2,先氧化I-,后氧化Fe2+
3、水解性:
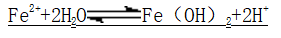
(1)防亚铁盐水解:加相应的稀酸
①FeSO4:加稀硫酸
②FeCl2:加稀盐酸
③Fe(NO3)2:不能加任何酸,防止HNO3将Fe2+氧化
(2)加热蒸干灼烧亚铁盐溶液
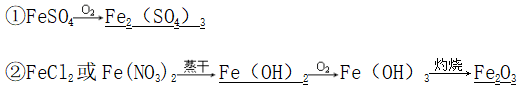
十五、铁盐的性质及应用
1、与KSCN溶液反应
(1)反应:
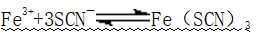
(2)现象:产生血红色溶液
(3)应用:检验Fe3+的最佳方法
2、强氧化性
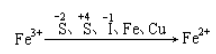
(1)与Fe反应
①反应:
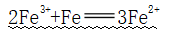
②应用:除去Fe2+中的Fe3+
(2)与Cu反应
①反应:
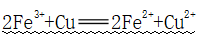
②应用:电子工业上腐蚀铜印刷电路板
(3)Mg、Al、Zn等活泼金属
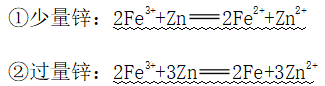
(4)与KI溶液反应
①反应:
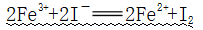
(FeI3不存在的原因)
②应用:溶液颜色变化不明显,产生紫黑色沉淀
(5)与SO2反应
①反应:
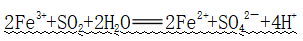
②应用:溶液由棕黄色变成浅绿色
(6)与H2S反应
①反应:
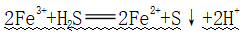
②应用:溶液由棕黄色变成浅绿色,产生黄色沉淀
(7)Na2S溶液
①少量Na2S:
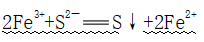
②过量Na2S:
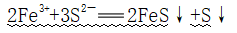
3、水解性
(1)离子反应:
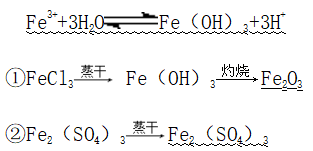
(2)溶液配制:先加入冷的稀酸,再加水稀释到相应浓度
(3)双水解
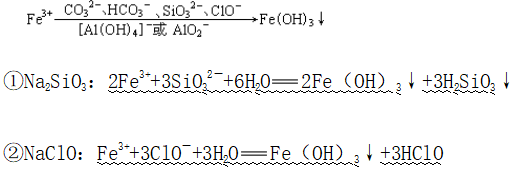
十六、检验Fe2+、Fe3+的常用方法
1、根据溶液颜色:
含有Fe2+的溶液显浅绿色,含有Fe3+的溶液显棕黄色。
2、用KSCN溶液和氯水
(1)流程:

(2)描述:
①取少量待测溶液于试管中,加入KSCN溶液,若溶液无明显变化,向该溶液中通入足量氯气,溶液变味血红色,则证明含有二价铁离子
②取少量待测溶液于试管中,加入KSCN溶液,若溶液变为血红色,则证明含有三价铁离子
3、用NaOH溶液
(1)流程:

(2)有关反应:
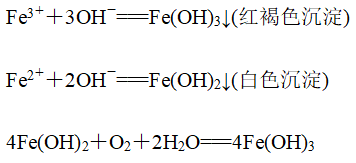
(3)描述:
①取少量待测溶液于试管中,加入氢氧化钠溶液,产生白色沉淀,后白色沉淀迅速变为灰绿色最后变为红褐色,则证明为二价铁离子
②取少量待测溶液于试管中,加入氢氧化钠溶液产生红褐色沉淀,则证明为三价铁离子
4、含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验:
将混合溶液分成两份分别于两支试管中,向其中一支试管中加入酸性高锰酸钾溶液,若酸性高锰酸钾紫红色褪去,则说明含有Fe2+;向另一支试管中加入KSCN溶液,若溶液变红,则说明含有Fe3+。
5、利用铁氰化钾溶液检验Fe2+:
取少量待测溶液于试管中,加入足量铁氰化钾溶液,若生特征蓝色沉淀则证明还有Fe2+:
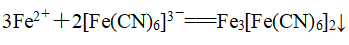

- 全部评论(0)