铜及其化合物性质知识点总结
时间:2023-08-13 17:41 来源:未知 作者:化学自习室 点击: 次 所属专题: 铜及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、单质铜的性质及应用
1、铜的原子结构
(1)电子排布式:
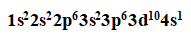
①最高能级电子数10
②最高能层电子数1
③未成对电子数1
④稳定性:Cu2+<Cu+
(2)价电子排布图:
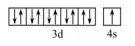
(3)原子结构示意图:
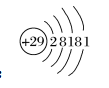
(4)周期表中位置:
第4周期第Ib族,位于Ds区
(5)晶胞结构(晶胞参数APM)
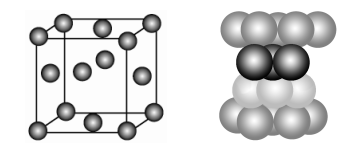
①堆积名称:面心立方最密堆积,堆积类型:A1型或铜型
②堆积方式:…ABCABC…
③配位数12
④晶胞中含Cu的个数:4
⑤晶胞密度:
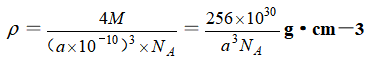
⑥空间利用率:

2、铜的物理性质
(1)颜色:呈红色或紫红色
(2)三性:导电性、导热性和延展性良好
3、与非金属单质反应
(1)与氧气反应:条件不同,产物不同
①加热:
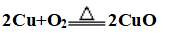
②常温:
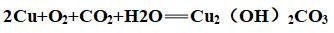
(2)与其他非金属反应
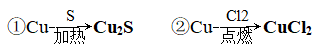
4、与酸反应
(1)稀硫酸
①普通条件:Cu不能置换出H2
②电解条件:
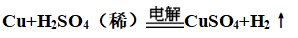
(2)浓硫酸:
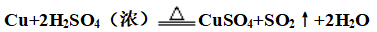
(3)浓硝酸:
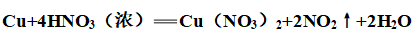
(4)稀硝酸:
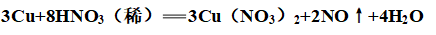
5、与盐溶液反应
(1)硝酸银:
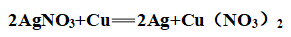
(2)氯化铁:
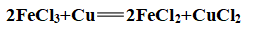
6、单质铜在化学实验中的应用
(1)除去某种气体中的氧气

(2)乙醇催化氧化的催化剂
①催化原理:
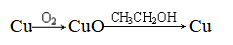
②催化反应:
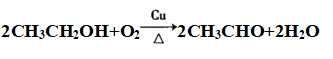
(3)防止可燃性气体燃烧回火的安全装置
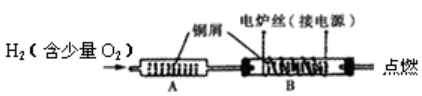
7、铜的冶炼“两方法”
(1)湿法炼铜:
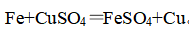
(2)高温炼铜
①工业上用高温冶炼黄铜矿的方法获得粗铜
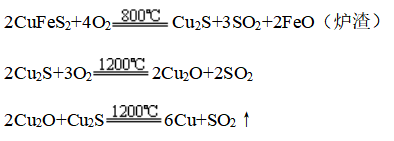
②电解精炼铜:用粗铜做阳极,失电子变为Cu2+,用纯铜棒做阴极即可得精铜
二、铜的氧化物和氢氧化物的性质及应用
1、氧化铜
(1)物性:黑色粉末状固体
(2)弱氧化性:
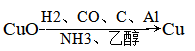
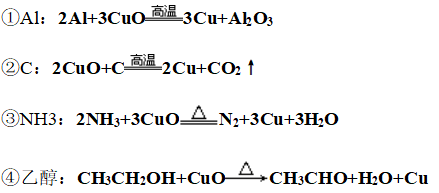
(3)热不稳定性
①反应:
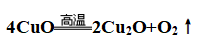
②原因:Cu+的价电子构型为3d10的稳定结构
2、氧化亚铜
(1)物性:砖红色固体
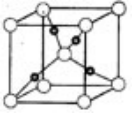
(2)Cu2O的晶胞(小黑点实心代表Cu原子)
①含Cu2O数:2
②配位数:Cu的配位数为2;O的配位数为4
(3)用途:作为红色玻璃和搪瓷的着色剂
3、氢氧化铜
(1)物理性质:蓝色不溶于水的固体
(2)化学性质
①弱碱性:
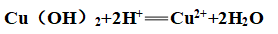
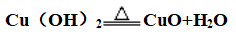
②不稳定性:
③弱氧化性:

④络合性:
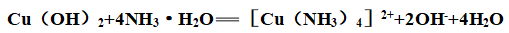
三、几种常见的铜盐
1、可溶性铜盐
(1)水解性:
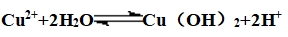
①防水解:加入相应的稀酸
②制无水物:
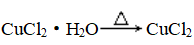 ,在HCl气氛中加热
,在HCl气氛中加热
(2)与碱反应
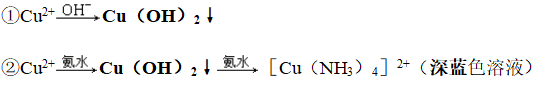
(3)硫酸铜晶体(CuSO4·5H2O)
①物性:蓝色晶体,俗称胆矾、蓝矾
②结构:[Cu(H2O)4]SO4·H2O
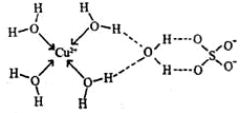
③晶体中存在的作用力:离子键、共价键、配位键、氢键
(4)硫酸铜的应用
①CuSO4:检验某些气体或液态有机物中微量水的存在
②硫酸铜溶液和消石灰配制波尔多液,其杀菌原理是重金属盐使细菌蛋白质变性
2、碱式碳酸铜
(1)俗名:铜锈或铜绿
(2)相当处理:Cu(OH)2和CuCO3组成的混合型化合物
(3)化学性质:具有Cu(OH)2和CuCO3的双重性质
①与盐酸反应:
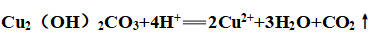
②热分解反应:

③与氢气反应:
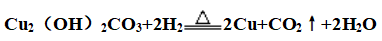
④与铝反应:
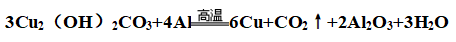

- 全部评论(0)
