铁和铁化合物考查方式探析
时间:2016-01-18 21:54 来源: 作者:陈岚 点击: 次 所属专题: 铁及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.考查与Fe2+、Fe3+有关的离子共存问题
例1.(2005年广东高考化学试题)下列各组离子一定能大量共存的是( )
A.在含大量Fe3+的溶液中 NH4+、Na+、Cl-、SCN-
B.在强碱性溶液中 Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中 NH4+、Al3+、SO42- 、NO3-
D.在PH=1的溶液中 K+、Fe2+、Cl-、NO3-
解析:A项Fe3+与SCN-发生络合反应而不能大量共存;C项溶液中PH=13,显碱性,OH-与NH4+、Al3+不能共存;D项溶液中H+、NO3-、Fe2+会发生氧化还原反应而不能大量共存。答案为B项。
2.考查与铁及其化合物有关的离子方程式的书写
例2.(选自04、05年高考试题)下列离子方程式书写正确的是( )
A.向溴化亚铁溶液中通入过量氯气
Fe2++2Br-+2CI2==Fe3+ + Br2+ 4CI-
B.三氯化铁溶液跟过量氨水反应
Fe3++3NH3•H2O == Fe(OH)3↓+3NH4+
C.硫化亚铁与盐酸反应
S2-+2H+==H2S↑
D.氯化亚铁溶液中通入少量氯气
CI2+ Fe2+==Fe3+ +2CI-
解析:A、D项电荷不守恒;C项FeS为难溶物,不能拆开写成离子形式。答案为B项。
3.综合考查铁及其化合物的性质
例3.(2005年全国高考理综试题•云南、陕西等省市卷)A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1:1和1:2,高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入氢氧化钠溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
⑴ A的化学式(分子式)是 。
⑵ B煅烧生成C和D的化学方程式是 ;
甲元素的单质与F溶液反应的离子方程式是 。
⑶ 往G溶液中加入NaOH溶液发生的现象是 。
解析:由C(固体) ![]() F
F ![]() 红褐色沉淀
红褐色沉淀 ![]() C,可知C为Fe2O3,这样A、B中均含有Fe元素,另一元素为非金属元素。再结合A、B中两元素原子个数比很容易推出A为FeS,B为FeS2。
C,可知C为Fe2O3,这样A、B中均含有Fe元素,另一元素为非金属元素。再结合A、B中两元素原子个数比很容易推出A为FeS,B为FeS2。
答案:⑴ FeS ⑵ 4FeS2+1102 2Fe2O3+8SO2 2Fe3++Fe 3Fe2+ ⑶ 生成的沉淀由白色变成灰绿色最终变成红褐色
4.与其他元素化合物相结合考查计算能力
例4.(2004年全国高考理综试题• 云南、湖南等省市卷)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。
请填空:
⑴ ①中引发铝热反应的实验操作是____________,产物中的单质B是_______。
⑵ ②中所发生的各反应的化学方程式是_______________________。
⑶ ③中所发生的各反应的离子方程式是______________________。
⑷ 若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_____, c(Fe2+)为_____。
解析:
⑴ 引发铝热反应的实验操作:加少量KClO3,插上Mg条并将其点燃(Mg燃烧放出的热使氧化剂KClO3分解产生氧气,氧气燃烧继续提供较高温度使反应发生)。试样A进行铝热反应时,反应为2Al+Fe2O3 === 2Fe+Al2O3(因Mg比Al活泼,Al不与 MgO反应),生成单质B为Fe。
⑵ MgO和Fe2O3都能与盐酸反应,化学方程式为Fe2O3+6HCl==2FeCl3+3H2O、MgO+2HCl==MgCl2+H2O。
⑶ B(Fe)与C溶液反应时,因产生H2且反应后溶液中无Fe3+,则C为FeCl3、MgCl2、HCl的混合液,Fe还原Fe3+并与HCI反应置换出H2,溶液D为FeCl2、MgCl2的混合液,离子方程式为Fe+2H+==Fe2++H2↑、Fe+2Fe3+==3Fe2+。
⑷ n(MgO)=n(Fe2O3)=xmol,有40x+160x=20,x=0.1mol,则c(Mg2+) =0.1mol/0.15L=0.67mol·L-1。由实验②③④知,最终溶液的溶质是FeCl2和MgCl2,据电荷守恒有2×n(Mg2+)+2×n(Fe2+)=1×n(Cl-),又n(Mg2+) =0.1mol,n(Cl-)=n(HCl )=6.0 mol·L-1×0.15 L =0.9mol,则n(Fe2+)=(0.9mol-0.2mol)/2=0.35mol,故c(Fe2+)=0.35mol/0.15L= 2.3mol·L-1。
5.以无水FeSO4制备为载体考查推理能力
例5.(2004年全国高考理综试题•甘肃、宁夏等省区卷)下图表示某种盐的制备步骤:
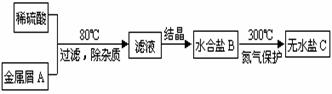
已知:水合盐B含有45.3%的水;无水盐C焙烧分解,放出两种无色刺激性气体E和F,并生成红棕色固体D。请写出物质的化学式或名称:
A. ,B. ,C. ,D. ,E. ,F. 。
解析:本题的突破口在于无水盐C焙烧产物的物理性质,即由“红棕色固体”和“两种无色刺激性气体”可推断D可能是Fe2O3,E、F可能是SO2和SO3。结合框图中B→C是无氧环境(N2保护),可推断C可能是FeSO4,所以A可能是Fe,那么B就是含结晶水的FeSO4,通过B含有45.3%的水可计算出其中含有7个结晶水。将推断出的A→F的可能物质带入框图及已知条件检验,可发现这种推断是正确的。故A为Fe,B为FeSO4·7H2O,C为FeSO4 ,D为Fe2O3,E为SO2,F为SO3或E为SO3,F为SO2。
6.以铁与水反应、FeCl3·6H2O晶体制备为载体考查实验能力
例6.(2005年北京高考理综试题)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
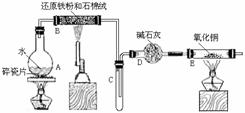
⑴ 装置B中发生反应的化学方程式是 。
⑵ 装置E中的现象是 。
⑶ 停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法: 。
⑷ 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:![]()
①步骤I中通入Cl2的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括: 。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明) 。
解析:
⑴ 装置B中发生反应的化学方程式为3Fe+4H2O(g) Fe3O4+4H2。
⑵ E中H2置换出CuO(黑色)中的Cu(红色),同时生成H2O,现象为黑色固体变为红色,右端管壁有水珠。
⑶ B管中固体主要是Fe3O4,其中也可能含有少量未反应完的铁粉。Fe3O4与稀盐酸反应的方程式为Fe3O4+8HCI==FeCI2+2FeCI3+4H2O。要检验滤液中是否含有Fe3+,可取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色。
⑷ ① 步骤I中通入Cl2的作用是将滤液中含有的Fe2+氧化成Fe3+。② 步骤II的主要操作包括加热浓缩、冷却结晶、过滤。③ 该流程中需保持盐酸过量,主要是FeCI3会发生水解反应,即 3Fe3++3H2O ![]() Fe(OH)3+3H+,过量盐酸能抑制FeCl3的水解。
Fe(OH)3+3H+,过量盐酸能抑制FeCl3的水解。
7.以Fe(OH)2制备为载体考查实验创新能力
例7.(2003年全国高考理综试题• 新课程卷)用下面两种方法可以制得白色的Fe(OH)2沉淀。

方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
⑴ 用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
⑵ 除去蒸馏水中溶解的O2常采用 的方法。
⑶ 生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
⑴ 在试管Ⅰ里加入的试剂是 。
⑵ 在试管Ⅱ里加入的试剂是 。
⑶ 为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
⑷ 这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
解析:
方法一:⑴由于水溶液中Fe2+易被氧化和水解,配制时需加铁屑和稀硫酸。⑵由于气体的溶解度是随温度的升高而降低的,可通过煮沸蒸馏水的方法来使蒸馏水中的O2逸 出。 ⑶通过该操作能避免生成的Fe(OH)2沉淀与O2接触而被氧化,以便于能长时间地观察到 Fe(OH)2的颜色。
方法二:观察题给装置,试管Ⅱ是开口式,无法用产生的气体将试液压入试管Ⅰ中,所以制取FeSO4应放在试管Ⅰ中,而在试管Ⅱ中盛 NaOH 溶液。在制取 Fe(OH)2之前必须要创造一个无氧的环境。排出O2的方法是先将止水夹打开使 Fe 与稀H2SO4反应,让产生的H2将装置中的O2和溶液中的溶解氧赶出。然后再通过检验排出的H2的纯度来确定O2是否排净。当排出的 H2己纯净后,将止水夹关闭,生成的FeSO4溶液会被H2的气压压入试管Ⅱ与不含氧的 NaOH 溶液反应生成白色絮状的Fe(OH)2。由于整个装置中都充满了H2,可避免Fe(OH)2与O2的接触,使得Fe(OH)2能保持较长时间。
答案:
方法一 :⑴ 稀H2SO4和铁屑 ⑵ 煮沸 ⑶避免生成的Fe(OH)2沉淀接触O2
方法二 :⑴ 稀H2SO4、铁屑 ⑵ NaOH溶液 ⑶检验试管Ⅱ出口处排出的H2的纯度,当排出的 H2纯净时,再夹紧止水夹 ⑷ 试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入

- 全部评论(0)
