教材分析(必修一):化学键
时间:2023-08-08 16:19 来源:未知 作者:张德金 点击: 次 所属专题: 化学键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

离子、原子、分子之间通过什么作用力形成宏观物质呢?
有些靠化学键,有些靠分子间作用力。
一、化学键
化学键是分子内或晶体内相邻两个或多个原子(离子)间强烈的相互作用。化学键包括离子键、共价键、金属键等。
二、离子键
1、离子键:
带相反电荷的离子之间的相互作用叫离子键。
比如在NaCl中,Na+和Cl-之间的作用力是离子键。
同样,Na2SO4中Na+和SO42-之间的作用力也是离子键。
2、离子化合物:
由离子键构成的化合物叫离子化合物。
如NaCl、KCl、MgCl2、CaCl2、Na2SO4、ZnsO4、NaOH等。
由金属阳离子或铵根(NH4+)构成的化合物多数是离子化合物。
3、离子化合物的电子式表示
(1)原子的电子式写法:
![]()
①最外层电子一般可以都用“·”表示。
②在单质中,金属单质或还原性强的,电子可以用“×”表示。在化合物中,还原性强的可以用“×”表示。
③电子少于或等于4个时,每个电子都是单电子表示。电子多于4个时,有的电子以电子对的形式表示。一般采用对称性表示。
(2)八隅[Yú]体规则(或称八电子规则):
指原子一般会通过得到、失去或共享电子达成8个电子(H、Li、Be为2个电子),此时处于稳定状态。主族元素一般都依从这个规则。
(3)简单离子化合物的电子式的表示方法
NaCl:![]()
简单阳离子:只有电荷表示,没有电子和“[ ]”。
简单阴离子:既有电荷表示,又有电子和“[ ]”表示。
同种离子不能合并写。
MgO:![]()
Na2O:![]()
MgCl2:![]()
AlF3:![]()
(3)以电子式表示Na与Cl形成NaCl的过程
![]()
用原子表示离子键的形成过程时,原子之间的箭头不能省略,多个同种原子不能合并写。
例如:AlF3的形成过程:
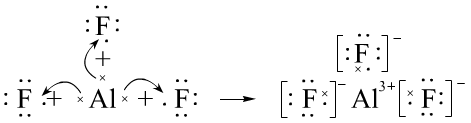
三、共价键
1、共价键
(1)Cl形成Cl2时,为什么要形成共价键,怎么形成共价键?
Cl的最外层有7个电子,不稳定。
如果Cl周围有Na,它会立刻与Na发生得失电子的反应,变为稳定的Cl-,并且可能形成离子键。
如果Cl周围有Cl,想形成8电子稳定结构,都需要得到1个电子。
解决办法:两个氯原子各提供1个电子,形成1对共用电子对,这对共用电子对归双方共用。
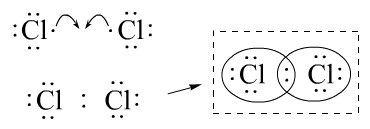
Cl2中氯原子拥有的电子的算法:7-1=6,然后6+2=8。
氯原子形成氯分子的过程:
![]()
练习:氧原子怎么形成共价键?
答案:
![]()
写出N2的电子式:
![]()
(2)共价键:原子之间通过形成共用电子对所形成的相互作用叫共价键。
不同非金属原子之间也能形成共价键,如HCl分子的形成过程:
![]()
H2O分子的形成过程:
![]()
共价化合物的电子式中没有电荷,没有[ ]。
用原子表示形成共价键的过程时,没有电子转移箭头,多个同种原子合并写。
练习:写出NH3、CH4的电子式
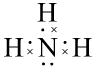 、
、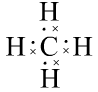
2、共价化合物
只由共价键构成的化合物叫共价化合物。如HCl、H2O、CO2、CH4等。
练习:写出CO2、H2O2、HClO的电子式
![]() 、
、![]() 、
、![]()
3、如果化合物中既有离子键,又有共价键,这样的化合物还是离子化合物,如NaOH、NaClO、Na2O2、NaCN、NH4Cl等。
写出NaOH的电子式,分析步骤如下:
(1)Na失去一个电子给了OH原子团,变为NA+。
(2)O最外层6个电子,形成8电子稳定结构需要2个电子。
H最外层1个电子,形成2电子稳定结构需要1个电子。
从Na得到的1个电子,如果给O,O最外层变为7个电子,还需要1个电子。
O和H之间形成1对共用电子对即可。
(3)所以NaOH的电子式为![]() 。
。
练习:写出NaClO、Na2O2、NaCN、NH4Cl的电子式:
![]() 、
、![]() 、
、![]() 、
、
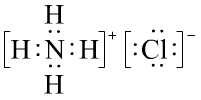 或
或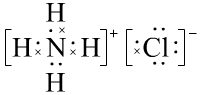 (此电子式中有配位键,解释时需要加入配位键的定义)
(此电子式中有配位键,解释时需要加入配位键的定义)
4、极性键、非极性键
(1)非极性键:共用电子对不偏向于任何一个原子,这样的共价键叫非极性键。像H2、Cl2、O2、N2等,或H2O2、Na2O2的两个O之间。
(2)极性键:共用电子对偏向于吸引电子能力强的原子,使这个原子相对显负电性,另一个原子相对显正电性,这样的共价键叫极性键。如HCl、H2O、NH3、CH4、CO2、HClO等,或Na2CO3的C和O之间。
四、结构式、空间结构、分子结构模型
1、结构式:将电子式中的电子对只保留共用电子对,并将一对共用电子对改用一条“—”表示,所形成的式子,叫结构式。
如![]() 的结构式为H—O—H。
的结构式为H—O—H。
的![]() 结构式为O=C=O。
结构式为O=C=O。
![]() 的结构式为
的结构式为![]() 。
。
![]() 的结构式为
的结构式为 。
。
2、分子空间结构的名称
分子的空间结构(分子的空间构型或几何构型):指分子中各原子在空间相对排列关系。
利用CH4的空间结构进行演化:
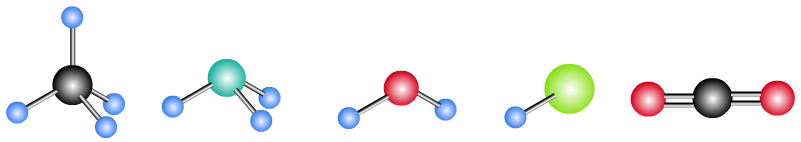
CH4:正四面体形。
NH3:三角锥形。
H2O:V形或折线形。
CO2:直线形。(可用甲烷结构进行双键合并得到)
3、分子结构模型
根据原子半径大小,用不同大小和颜色的球表示原子,用棍表示共价键,按原子的空间分布和作用力制作的模型,叫分子结构模型。
以下为CH4、NH3、H2O、HCl、CO2的分子结构模型:
五、化学反应的实质
1、化学反应是反应物中的原子或离子重新组合为产物的一种过程。
这个过程可以简化为两步:反应物中化学键先断裂,产物中化学键后形成。
比如H2和Cl2生成2HCl:
(1)H2和Cl2中的化学键断裂,生成2H和2Cl。
(2)2H和2Cl形成2个新的共价键,产生2HCl。
2、一些化学反应过程中的键的变化分析
(1)NaCl溶液与AgNO3溶液生成白色沉淀AgCl:
没有键的断裂,只有离子键的形成。
(2)HI气体的受热分解2HI H2+I2:
H2+I2:
既有极性共价键H—I的断裂,又有非极性共价键H—H和I—I的形成。
(3)固体NH4Cl的受热分解NH4Cl NH3↑+HCl↑:
NH3↑+HCl↑:
既有离子键的断裂,极性共价键N—H的断裂,又有极性共价键H—Cl的形成。
(4)固体Na2O2与气体CO2反应2Na2O2+CO2=2Na2CO3+O2:
既有离子键的断裂,非极性共价键O—O的断裂,又有离子键的形成,极性共价键C—O的形成,非极性共价键O=O的形成。(还有C=O的部分断裂)
六、分子间作用力和氢键
物质凝聚在一起,除了靠化学键之外,还有可能靠分子之间稍弱一点的一种作用,这种作用叫分子作用力。
1、分子间作用力:
分子之间或惰性气体的原子之间的作用力。这种作用力一般比化学键弱。
像固态CO2、液态Br2、固态I2中,分子之间都存在着分子间作用力。
2、氢键:
当分子中存在N或O或F和H时,一个分子中的N或O或F与另一个分子中的H会形成一种作用力,这种作用力叫氢键。
分子间形成的氢键也是一种分子间作用力。
它比一般的分子间作用力强,比化学键弱。它会导致熔沸点的升高。
液态或固态的H2O、NH3、HF中,都存在氢键。

- 全部评论(0)
