常考物质转化关系
时间:2023-08-12 09:43 来源:未知 作者:化学自习室 点击: 次 所属专题: 物质转化
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、直线型转化
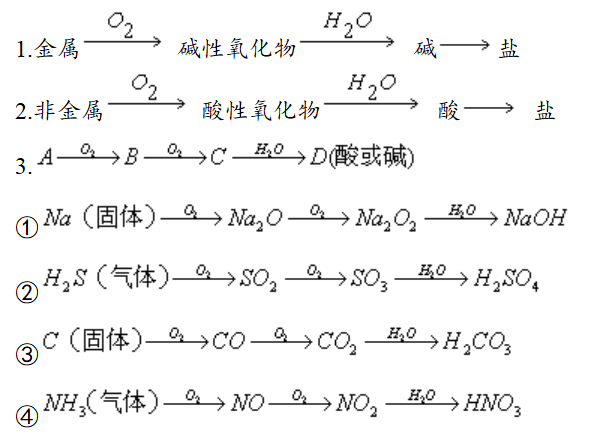
二、交叉型转化

三、三角形转化
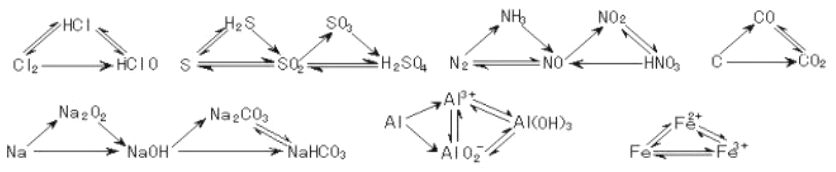
四、元素及其化合物的转化关系(注意向前走得通,倒退能否行)
1、Na → Na2O → Na2O2→ NaOH → Na2CO3→ NaHCO3→ NaCl → Na
Na → NaOH → CaCO3→ CaCl2→ CaCO3→ CaO →Ca(OH)2→ NaOH
2、Mg → MgO → MgCl2→Mg(OH)2→ MgSO4→ MgCl2→ Mg
3、Al → Al2O3→ AlCl3→Al(OH)3→ Al2(SO4)3→Al(OH)3→ Al2O3→ Al → NaAlO2→Al(OH)3→ AlCl3→ NaAlO2
4、Fe → Fe2O3→ FeCl3→Fe(NO3)3→Fe(OH)3→ Fe2(SO4)3→ FeSO4→Fe(OH)2→Fe(OH)3→ FeCl3→ Fe(SCN)3
5、Cu→CuO→CuSO4→Cu(OH)2→ CuO → Cu → CuCl2→ [Cu(NH3)4]SO4
6、C→ CO→ CO2→ CO → CO2→ CaCO3→ Ca(HCO3)2→ CO2→ Al(OH)3
7、Si → SiO2→ Na2SiO3→ H2SiO3→ SiO2→ Si(粗硅) → SiCl4→ Si (纯硅)→ SiO2→ SiF4
8、NH3→ N2→ NO→ NO2→ HNO3→ NO2→ N2O4
NH3→ NH4Cl → NH3→ NH3·H2O → (NH4)2SO4→ NH3→ NO → HNO3→Cu(NO3)2→ NO2→ HNO3→
9、H2S → S → SO2→ SO3→ H2SO4→ SO2→ H2SO4→ BaSO4
10、Cl2→ HCl → Cl2→ NaClO → Cl2→ Ca(ClO)2→ HClO → O2
五、常考反应转化
1.A+酸→水+B
A可能为
(1)碱(反应略)
(2)碱性氧化物(反应略)
(3)单质
![]()
(4)酸性氧化物 SO2+2H2S=3S↓+2H2O
(5)不成盐氧化物NO+2HNO3(浓)=3NO2+H2O
(6)酸
HCl+HClO=Cl2↑+H2O
![]()
H2O2+H2SO3=H2SO4+H2O
(7)醇 (反应略)
2.A+B→C+D+H2O
(1)非氧化还原反应:
①NaHSO4+Ba(OH)2→
②Mg(HCO3)2+Ca(OH)2→(两种沉淀)
③AlCl3+NaOH→
④NaAlO2+HCl→
⑤碳酸盐+HCl等
(2)氧化还原反应:
①单质+H2SO4(浓)→
②单质+HNO3→
③SO2(或H2S)+HNO3→
④Cl2(或S)+NaOH→
⑤HCl(浓)+MnO2(或KClO3、Ca(ClO)2等)→
3.物质A+H2O→气体
(1)A为气体:
①F2→O2
②NO2→NO
③CO→CO2+H2
(2)A为固体单质:
①Na(K、Ca)+H2O→H2
②Fe(或C)+H2O→H2
(特殊:Al(或Si)+NaOH+H2O→H2)
(3)A为固体化合物:
①Na2O2+H2O→O2
②CaC2+H2O→C2H2
③Al2S3+H2O→H2S+Al(OH)3
④Mg3N2+H2O →NH3+Mg(OH)2
(4)特殊条件下产生气体
①NaCl+H2O(电解)→H2+Cl2CuSO4+H2O(电解)→O2
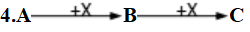
(1)非氧化还原反应:
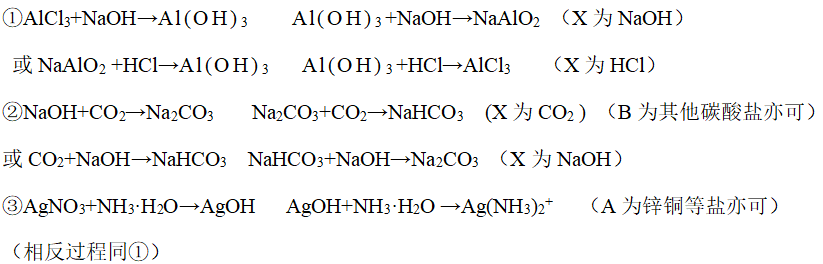
(2)氧化还原反应
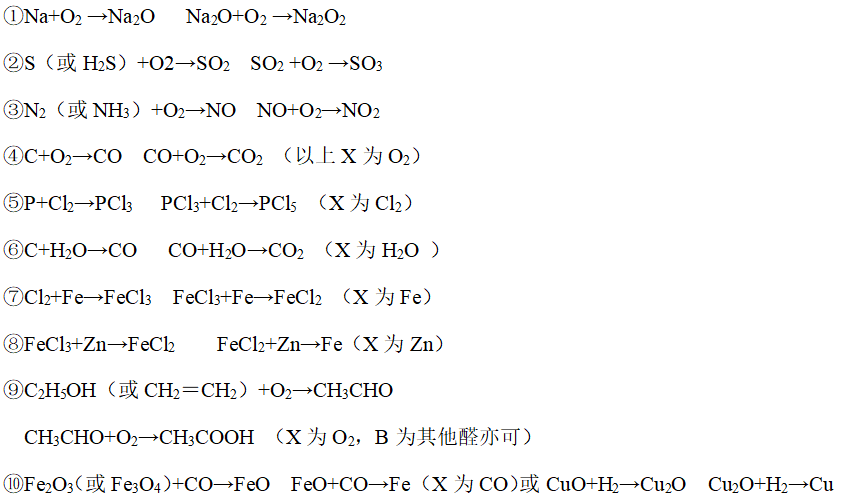
六、有机物之间的相互转化
1、直线型转化:(与同一物质反应)
![]()
2、交叉型转化
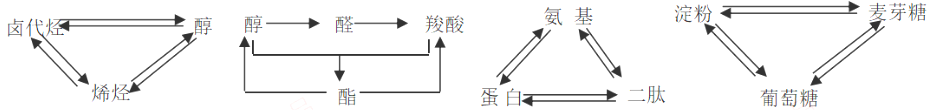
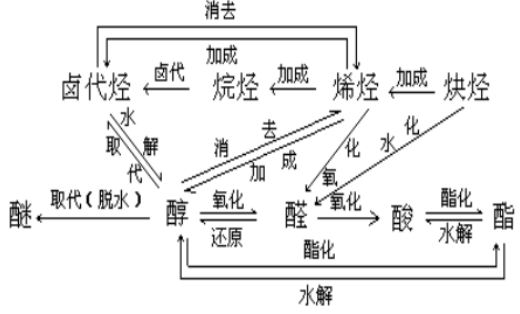
3、整体转化

- 全部评论(0)
