结晶小专题
时间:2023-12-18 09:29 来源:未知 作者:化学自习室 点击:次 所属专题: 结晶
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、结晶方法和种类
1、蒸发结晶
(1)实验装置

(2)适用范围
利用物质在同一溶剂中溶解度不同,进行固-固(均溶)分离
(3)原理
主要是指将所需要进行处理的溶液中的溶剂,通过加热升温的方式,让溶剂脱离溶质的过程,即利用加热的方式减少溶液中的水分,使溶质从溶液中析出的操作。
(4)操作
①安装好装置
②添加待蒸发液至蒸发皿中
③加热
④停止加热
(5)注意事项
①蒸发皿可直接加热,固定在铁架台的铁环上;
②加热时用玻璃棒不断搅动,防止液体溅出,蒸发皿出现较多固体时停止加热,利用余热将溶液蒸干
③蒸发皿中液体的量不得超过容积的2/3
④蒸发过程中必须用玻璃棒不断搅拌,防止因局部温度过高儿使液体飞溅
⑤蒸发结晶不该把液体完全蒸干才停止加热,应该待有较多晶体析出时便停止加热,利用余热将剩余水分蒸干。
2、冷却结晶
(1)实验装置

(2)适用范围
冷却结晶适用于一些在高温时不稳定的物质的结晶,包括易水解和带结晶水的
(3)原理
①降温结晶的原理是温度降低,物质的溶解度减小,溶液达到饱和了,多余的即不能溶解的溶质就会析出。
②如果两种可溶物质混合后的分离或提纯,谁更容易达到饱和,就用谁的结晶方法,如碳酸钠中含有少量的氯化钠杂质,就要用到碳酸钠的结晶方法即降温结晶。
③溶解度曲线呈明显上升趋势的物质,其溶解度随温度变化较大,一般用降温结晶(硝酸钾)
(4)操作
冷却结晶先要加热浓缩得到热饱和溶液,然后趁热过滤除去不溶性杂质,再冷却结晶,过滤,得到的晶体中还可能含有其他杂质,若要进一步提纯,再进行重结晶。
(5)注意事项
①冷却热饱和溶液结晶法(简称冷却结晶法)与蒸发结晶法的区别:冷却结晶:先加热后冷却,适用于溶解度随温度升高而增大随温度减小而降低的物质。如KNO3.蒸发结晶:就是一直加热,直到析出晶体,使用于溶解度随温度变化不大的物质。如NaCl 。
②此法适用于的溶质,必须满足“溶质的溶解度与温度成正比。即溶质的溶解度随温度的升高而升高”。在温度较高的情况下,且溶液已经达到饱和,此时冷却溶液,溶液的温度降低,溶质的溶解度下降,溶质就会长出晶体,结晶析出。工业上,此法常与浓缩联合使用,先浓缩溶液,然后使用冷却热饱和溶液结晶法,得到该溶质结晶,然后离心,得到此种溶质。
③在工业上的应用非常广泛,但是工业上在 应用是还必须考虑一个重要条件,就是,溶质的溶解度必须对温度非常敏感。即在温度下降时,溶质的溶解度必须要有一个比较大的改变,这样才可以得到大量的结晶,产生效益。否则不能适用。
3、常温结晶
(1)醇析结晶
①原理
指溶液中加入醇类而使某种物质溶解度降低而析出的过程。
②适用范围
醇析法适用于在其水溶液中加入乙醇时即析出结晶的试剂
③操作
加醇沉淀是将试剂溶解于水中,使之成为近饱和溶液,慢慢加入乙醇至沉淀开始明显析出。过滤,弃去最初析出的少量沉淀。再向滤液中加入一定量的乙醇进行沉淀,直至不再有沉淀析出为止。过滤,以少量乙醇分次洗涤沉淀,于适当温度下干燥。
(2)盐析结晶
①原理
指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程。所加入的物质叫做稀释剂
它可以是固体、液体或气体,但加入的物质要能与原来的溶互溶,又不能溶解要结晶的物质,且和原溶剂要易于分离。
4、重结晶
(1)原理
重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程。重结晶可以使不纯净的物质获得纯化,或使混合在一起的物质彼此分离。
(2)操作
①重结晶溶剂的选择
理想的重结晶溶剂应具备的条件有:①不与被提纯物质发生化学反应,②在高温度能溶解多的被提纯物质,而在室温或更低温度下只能溶解少量被提纯物质,且越少越好;③溶剂对杂质的溶解度很大(使杂质留在母液中不随提纯的晶体一起析出)或很小(在制成热的饱和溶液后,趁热过滤把杂质滤掉);④溶剂的沸点较低,易挥发,易与结晶分离除去:⑤能得较好的结晶,价格便宜、毒性小,易回收,操作安全。
②溶解固体样品,制成热的近饱和溶液
将待纯化的固体物质置于锥形瓶中,加入适量的合适溶剂,加热到沸腾。若没有完全溶解,应沸腾一会儿再观察,因为有的化合物溶解速率慢。若沸腾一会儿后,瓶中仍有固体,可再分批加量溶剂,并加热至沸,直至该物质全部溶解。此时基本为饱和溶液,为防止因温度下降溶质析出、溶剂加热挥发造成的损失,实际加入的溶剂量可比此时的量再过量10%~20%,即制成热的近饱和溶液。
③活性炭煮沸脱色,去除有色杂质
有机化学反应常产生有色杂质,这些杂质常会随滤液而行,当晶体析出时会黏附在晶体上,不易除去。而且,制得的热溶液有时会因存在有色的树脂状或不溶性杂质微粒而成为均匀的炫富体,使溶液浑浊,造成过滤困难。为保证液纯净,去除有色杂质的进一步影响,此时需将其除去。
④趁热过滤
固体被热溶剂溶解或活性炭脱色后,经过可将此时不溶性杂质去除。但为了避免热溶液中的溶质在过时因温度下降而析出晶体,必趁热快速过滤。若无热过滤漏斗,可利用布氏漏斗进行减压热过滤,并采取下列措施:①选用漏斗短且粗的漏斗;②事先将漏斗、吸滤瓶进行预热;③将吸滤瓶浸在热浴中热保护,并在过后尽快把液转移出来,防止液冷却析出晶体 。
⑤重新结晶析出
热液经自然冷却后物质便可以从溶液中结晶析出。晶体析出的关键是过饱和溶液的形成。形成过饱和溶液的方法有蒸馏法、冷却法、盐析结晶法等。有时因杂质的存在和温度等原因影化合物晶核形成和结晶生长而出现滤液已冷却和达到过饱和状态,但仍不见晶体析出或以油状物析出的情况。此时需采取相应措施促进晶体迅速析出,主要方法有:摩擦法,晶种引入法,过渡冷却法,过渡浓缩法,溶剂调节法等。
(3)适用范围
①无论选择怎样的溶剂,在任何情况下杂质的含量越多越不利于重结晶。杂质太多还可能影响结晶速率,甚至妨碍结晶的生成。因此,重结晶一般只用于纯化杂质含量在5%以下的固体有机化合物。杂质量多,则不宜从粗产品中直接重结晶,必须采取其他方法(如萃取、水蒸气蒸馏、减压蒸馏等)进行初步提纯后再用重结晶纯化。
②溶剂用量多总会降低重结晶的回收率,使用时要合理控制其用量。
③比较理想的重结晶溶剂是室温下杂质易溶,被纯化组分室温难溶、高温易溶。
二、高考考点
1、有机提取
【例1】己二酸是一种二元弱酸,通常为白色结晶体,微溶于冷水,易溶于热水和乙醇。
其制备的一种反应机理如下:

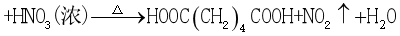 (未配平)。
(未配平)。
制备己二酸的装置如图所示(夹持、加热装置省略)。
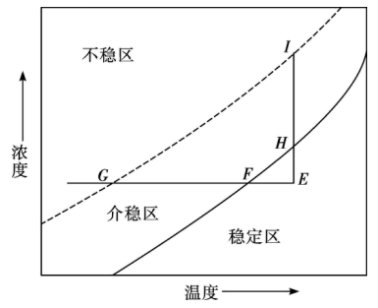
如图是己二酸的浓度与温度关系曲线图。介稳区表示己二酸溶液处于饱和状态,稳定区表示己二酸溶液处于不饱和状态。实验室常根据直线 从溶液a获取己二酸晶体,对应的实验操作为恒温蒸发结晶,过滤。
从溶液a获取己二酸晶体,对应的实验操作为恒温蒸发结晶,过滤。
2、工艺流程
【例1】某兴趣小组用铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备K2Cr2O7晶体,流程如下:
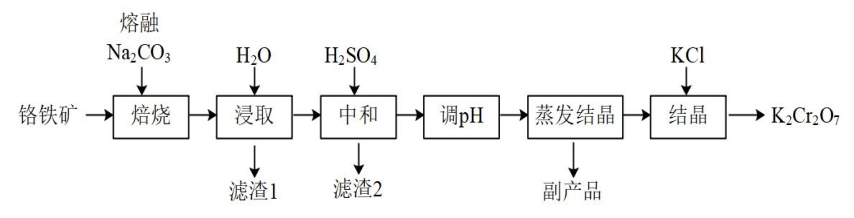
为结晶得到杂质较少的K2Cr2O7粗产品,请结合下图从下列选项中选出合理的操作并排序ADC
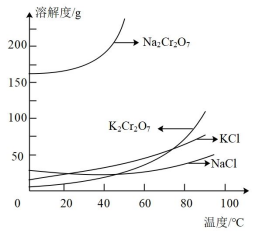
A.50℃蒸发溶剂
B.100℃蒸发溶剂
C.抽滤
D.冷却至室温
E.蒸发至溶液出现晶膜,停止加热
F.蒸发至溶液出现大量晶体,停止加热
【例2】利用火法炼铜后产生的含锌铜烟尘(主要成分为ZnO、CuO和少量铁的氧化物)制备活性氧化锌(ZnO),同时回收硫酸铵晶体的工艺流程如下:
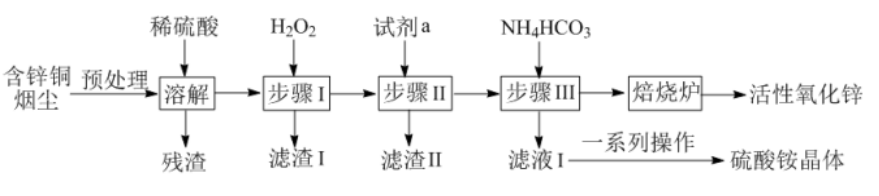
已知:25°C时溶液中金属离子物质的量浓度C与pH的关系如图所示;当溶液中某离子浓度C≤1.0 ×10-5mol·L-1时,可认为该离子沉淀完全。
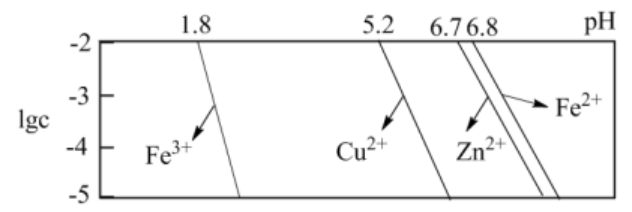
回答下列问题:
由滤液I得到硫酸铵晶体的一系列操作为蒸发浓缩、冷却结晶、过滤
3、综合实验
【例】苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式为:
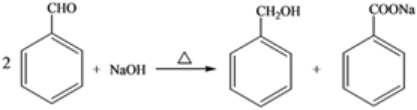
某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理:
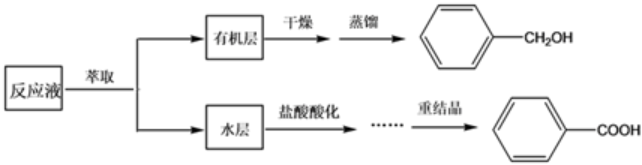
重结晶过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小。
请根据以上信息,回答下列问题:
苯甲酸在A、B、C三种溶剂中的溶解度(s)随温度变化的曲线如下图所示:
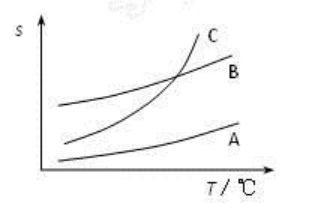
重结晶时,合适的溶剂是C;其理由是随温度升高溶解度增加较快;重结晶过程中,趁热过滤的作用是除去不溶性杂质,防止苯甲酸冷却后结晶析出
【例2】碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。KI还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I:3I2+6KOH= KIO3+5KI+ 3H2O
反应II:3H2S+KIO3=3S ↓+KI+ 3H2O
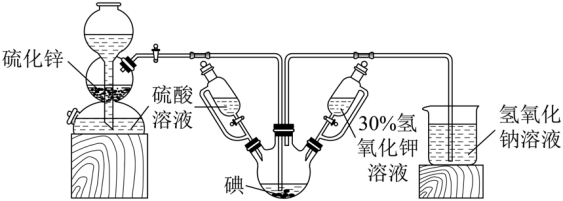
请回答有关问题。
实验室模拟工业制备KIO3流程如下:
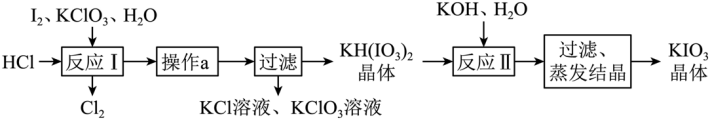
几种物质的溶解度见下表:
KCl | KH(IO3)2 | KClO3 | |
25℃时溶解度(g) | 20.8 | 0.8 | 7.5 |
80℃时溶解度(g) | 37.1 | 12.4 | 16.2 |
由上表数据分析可知,“操作A”为蒸发浓缩、冷却结晶(或重结晶)

- 全部评论(0)
