高中化学中大π键的题型中π电子数快速分析
时间:2023-12-29 08:40 来源:未知 作者:化学自习室 点击: 次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
我来给个简单的计算π电子数的办法吧,高中生很容易听得懂
首先,判断中心原子杂化情况,中心原子sp2杂化就只有一组大π键,如果中心原子是sp3杂化,那就会有两组相互垂直的。
先说第一类情况。
首先,高考题目的大π键体系,端位原子(H除外)一般会有四个轨道,即一个价层s轨道和三个价层p轨道
由于四个轨道里面只有一个轨道用于构成σ键,另一个垂直分子平面的p轨道会用于形成大π键,那么另外两个轨道都会对应这个原子的孤对电子。
显然,我们会希望保证这些孤对电子轨道都是满的,不然就变成不稳定的自由基了。
显然,我们可以得到如下公式:大π键电子数=总价电子数-σ键电子数(σ键数D的两倍)-中心原子(位于杂化轨道里的)孤对电子数(中心原子孤对电子对数的两倍)-端位原子的孤对电子数(端位原子剩余轨道数的两倍)
现在,我们看若干例子。
1.三氧化硫单体
中心原子显著的是sp2杂化,且三个杂化轨道都用于σ键。
对于每个氧而言,只需要出一个轨道和硫的杂化轨道成σ键,再出一个垂直于分子平面的p轨道用于形成大π键,那么每个氧都剩下两个轨道,三个氧就剩下6个轨道。
显然,分子里有3个σ键,总价电子数=6+6+6+6=24
现在,根据公式可以算得,此分子的大π键电子数=24(总价电子)-3×2(σ键电子) -6×2(氧的孤对电子)=6
所以三氧化硫单体里面有4中心6电子大π键
2.臭氧
中心原子也是sp2杂化,但是只成了两个σ键,所以有一对孤对电子在剩余的第三个杂化轨道里面。
按照一样的原则,分析每个端基氧也有2个孤对电子轨道。
于是,大π键电子数=18(总价电子)-2×2(σ键电子)-2(中心氧在杂化轨道上的孤对电子)-2×4(端位氧的孤对电子)=4
所以臭氧分子里有3中心4电子大π键
现在,看看中心原子sp杂化的情况。
由于中心原子有两个相互垂直的,可以用于形成大π键的p轨道,所以每个端原子要多拿出一个轨道,那么每个端原子就只有一对孤对电子了。
那么,此时两个大π键电子总数可以改写为:
π电子数=总价电子数-4(中心原子就两个杂化轨道,就只能成两个σ键,一定是4个电子)-4(两个端原子各一对孤对电子)
而每个大π键的电子数是π电子总数的一半,而且这个规律一定是成立的。
最典型的例子莫过于二氧化碳 ,硫氰根离子 和叠氮离子
这些总价电子数=16的直线型分子,很容易算出总共有16-4-4=8个π电子,分到每个大π键上就是两个大π键各四个。
至于为什么不能是一个3电子一个5电子……
这其实是分子对称性轨道对称性制约的,细讲的话就超过高中生理解能力了,还是不说了吧,记住就好,这个情况下π电子是平均分配两个大π键里的。
这些例子都比较简单,现在来个复杂一点的。
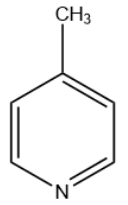
这个体系是个平面结构的,所以在高中范围内可以猜,这个体系有大π键。
现在,我们注意到,六元环的每个原子都采取了 sp2杂化的方式,所以大π键有且仅有一组。
现在,我们知道,那个甲基和大π键无关。
现在,来计算一下吧。
分子式C6H7N,总价电子数目是6×4+7+5=36
扣去构成六元环的σ电子数12个(6根键)
扣去六元环和甲基成键的电子数8个(甲基内部三根键,六元环和甲基之间一根)
扣去六元环上的C-H键电子数8个(4根键)
扣去氮在sp2杂化轨道上的一对孤对电子(2个)
最后只只剩下6个电子,那么这些电子就是分子的大π键电子,
所以是6中心6电子大π键。
更简单的办法,把不参与大π键的基团都换成H.

- 全部评论(0)
