11-15号元素及其化合物知识要点简介
时间:2024-03-21 10:32 来源:未知 作者:张德金 点击: 次 所属专题: 元素化合物简介
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、钠Na
大量存在于海水中,矿物主要有钠长石NaAlSi3O8、岩盐NaCl、钠硝石NaNO3等。
1、钠单质,银白色金属,密度比水小,比煤油大,保存在煤油中。
(1)金属性非常强,与大多数非金属能反应。
常温下在空气中与氧气反应。
4Na+O2=2Na2O
在空气中点燃生成淡黄色的Na2O2。
2Na+O2=点燃=Na2O2
与Cl2、Br2、I2、S、N2、H2等反应,生成非金属的最低价化合物。
(2)与水反应。与水溶液反应时,先和水反应。
2Na+2H2O =2NaOH+H2↑
2Na+2H2O+CuSO4=Cu(OH)2+Na2SO4+H2↑
2Na+2HNO3(稀) =2NaNO3+H2↑

2、Na2O,白色固体,碱性氧化物。
(1)与水反应,生成NaOH。与酸性氧化物、酸能反应。
Na2O+H2O =2NaOH
Na2O+CO2=Na2CO3
Na2O+2HClO4=2NaClO4+H2O
(2)在空气加热能生成Na2O2。
2Na2O+O2=Δ=2Na2O2
3、Na2O2,浅黄色固体,过氧化物,不稳定,有强氧化性和强还原性。(氧的稳定价态-2,其次是0,-1是不稳定价态)
(1)与H2O、CO2反应。显示Na2O2的不稳定性和歧化反应能力。
可以理解为NA2O2→Na2O+1/2O2,Na2O再与H2O、CO2反应。
2Na2O2+2H2O =4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
(2)强氧化性
Na2O2+SO2=Na2SO4
3Na2O2+Fe2O3=2Na2FeO4+Na2O
3Na2O2+Cr2O3=2Na2CrO4+Na2O
(3)强还原性
5Na2O2+2MnO4-+16H+=5O2↑+2Mn2++10Na++8H2O
4、NaOH,又叫烧碱、火碱、苛性碱,是强碱,白色固体,强腐蚀性。有很强的吸水性,可以当干燥剂。溶于水时放出大量热。盛放NaOH固体用塑料瓶,盛放NaOH稀溶液用玻璃瓶,但瓶塞要用橡胶塞。

(1)与各种酸、酸性氧化物能反应。
NaOH+HF=NaF+ H2O
2NaOH+N2O3=2NaNO2+H2O
(2)与各种弱碱盐能生成弱碱。
NaOH+NH4NO3=NaNO3+NH3·H2O
(3)工业制取NaOH用电解饱和食盐水。
5、钠盐Na+
(1)检测Na+的方法是利用焰色试验,火焰显示为黄色。
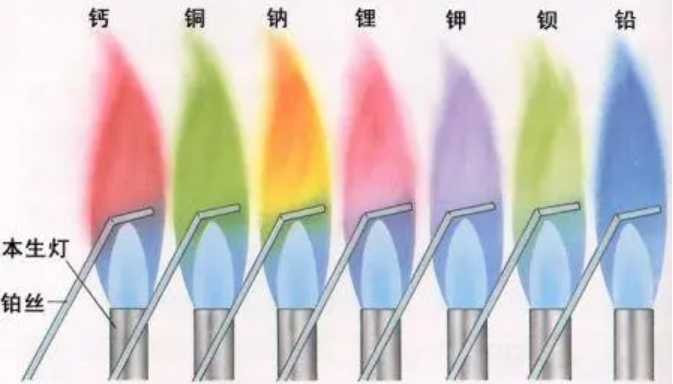
(2)Na+很难发生复分解反应和氧化还原反应。
(3)用钠盐制金属钠时,需用熔融的NaCl。
2NaCl(熔融)=电解=2Na+Cl2↑
不能用电解NaCl水溶液的方式。
2NaCl+2H2O =电解=2NaOH+H2↑+Cl2↑
(4)Na2CO3,纯碱,溶液的碱性较强,用于造纸、制皂、制洗涤剂、玻璃生产等。
Na2CO3+2HCl(过量)=2NaCl+H2O+CO2↑
Na2CO3+HCl(少量)=NaCl+NaHCO3
纯碱的生产主要采用联合制碱法(侯氏制碱法)制得:先将饱和食盐水中通入过量氨气,再通入过量二氧化碳,得到碳酸氢钠沉淀。再将过滤得到的碳酸氢钠加热分解可得碳酸钠。
NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(5)NaHCO3,小苏打,主要用于食品生产。能和强酸、强碱反应。稳定性较差,分解为碳酸钠。
2NaHCO3=Δ=Na2CO3+H2O+CO2↑
(6)Na2SO4·10H2O又叫芒硝,是储热材料。
二、镁Mg
含镁的主要矿物有白云石MgCO3·CaCO3、菱镁矿MgCO3、光卤石、泻盐MgSO4·7H2O等。
1、金属镁,活泼金属,表面自动形成致密氧化膜,金属在空气中稳定存在。
(1)在空气中剧烈燃烧,发出白光,除生成MgO外,有少量氮化镁生成。
3Mg+N2=点燃=Mg3N2
很多金属氮化物遇水能发生水解反应,如氮化镁,
Mg3N2+6H2O =3Mg(OH)2+2NH3↑
(2)在CO2中能燃烧。
2Mg+CO2=点燃=2MgO+C
(3)与热水能反应。
Mg+2H2O =Δ=Mg(OH)2+H2↑
(4)与一些盐能发生置换反应。
2Mg+TiCl4=高温=2MgCl2+Ti
(5)与卤代烃制造格氏试剂,格氏试剂在有机合成上十分有用。
Mg+R-Cl=R-Mg-Cl
2、Mg(OH)2:中强碱,难溶于水。
从溶液中分离镁离子时,一般用生成Mg(OH)2的方法。而分离钙离子一般用生成CaCO3的方法。
Mg(OH)2易分解。
Mg(OH)2=Δ=MgO+H2O
3、关于镁的矿石:菱镁矿(碳酸镁)mgCO₃,白云石(碳酸镁钙)CaMg(CO₃)₂,光卤石(水合氯化镁钾)KCl·MgCl₂·6H₂O。
MgCO₃易分解。
MgCO₃=Δ=MgO+CO2↑
4、用海水制镁涉及到的反应有:
CaO+H2O+MgCl2=Mg(OH)2+CaCl2
Mg(OH)2+2HCl = 2H2O +MgCl2
MgCl2+6H2O= MgCl2·6H2O↓
MgCl2·6H2O=HCl气体/Δ=MgCl2+6H2O
MgCl2(熔融)=电解=Mg+ Cl2↑。
三、铝Al
亲氧元素,地壳中元素含量排第三。金属材料应用中,排第二。
1、金属铝,活泼金属,表面自动形成致密氧化膜,金属在空气中稳定存在。
(1)铝条在空气中不燃烧,铝粉在空气中猛烈燃烧。
(2)金属既能与酸反应,又能与碱反应。
2Al+6HCl=2AlCl3+3H2↑
Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
常温下与浓硫酸或浓硝酸发生钝化现象。
(3)与一些盐能发生置换反应。
(4)在高温下发生铝热反应。
2Al+Fe2O3=高温=Al2O3+2Fe
2、Al2O3,耐高温,可做耐高温材料。
两性氧化物,与酸碱都能反应,难溶于水。
Al2O3坩埚不能加热强碱、纯碱等。
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+Na2CO3=2NaAlO2+CO2↑
3、Al(OH)3,两性氢氧化物,难溶于水,在水中生成时,易形成胶体。
与强酸、强碱都能反应。
Al(OH)3+NaOH=Na[Al(OH)4]
Al(OH)3+3HCl=AlCl3+3H2O
受热易分解。
2Al(OH)3=Al2O3+3H2O
4、铝盐和铝酸盐
(1)Al3+盐
①与少量强碱反应,生成白色沉淀Al(OH)3,与过量强碱反应,生成四羟基合铝酸盐。
Al3++3OH-=Al(OH)3↓
Al3++4OH-=[Al(OH)4]-
②与过量氨水反应,生成白色沉淀后,不会继续溶解。
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
③与Na2CO3、NaHCO3、Na2S等发生双水解反应。
2AlCl3+3Na2CO3+3H2O =2Al(OH)3↓+3CO2↑+6NaCl
④AlCl3,共价化合物,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚分子(Al2Cl6)形式存在。
AlCl3为缺电子的平面正三角形分子。
⑤Al3+盐在水溶液中易水解形成胶体,有净水作用。
(2)[Al(OH)4]-盐(四羟基合铝酸盐)或AlO2-盐(偏铝酸盐)
①与少量强酸反应,生成白色沉淀Al(OH)3,与过量强碱反应,生成Al3+盐。
[Al(OH)4]-+H+=Al(OH)3↓+H2O
[Al(OH)4]-+4H+=Al3++4H2O
②与过量CO2反应,生成白色沉淀后,不会继续溶解。
[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
③水解后碱性很强,与NH4Cl能发生双水解反应。(NH4Cl一般不发生双水解反应)
Na[Al(OH)4]+NH4Cl=Al(OH)3↓+NH3·H2O+NaCl
5、制铝金属的反应
2Al2O3(熔融)=冰晶石/电解=4Al+3O2↑
四、硅Si
亲氧元素,地壳中元素含量排第二。以SiO2和硅酸盐的形式存在。
1、硅,是半导体材料。
有无定形硅和晶体硅两种同素异形体,晶体硅为灰黑色,无定形硅为黑色。晶体硅是共价晶体。
(1)与氟气、氧气、氯气能反应。
Si+2F2=SiF4(SiF4在常温下是气体)
Si+O2=Δ=SiO2
Si+2Cl2=高温=SiCl4
(2)与氢氟酸在有氧化剂时反应。但不与盐酸、硫酸、硝酸等反应。
3Si+18HF+4HNO3=H2SiF6↑+2NO↑+8H2O
(3)与强碱反应。
Si+2NaOH+2H2O =Na2SiO3+2H2↑
(4)真空高温下与MgO反应制Mg。
Si+2MgO=真空高温=SiO2+2Mg
2、SiO2,水晶、玛瑙、石英、砂子、燧石等主要成分都是SiO2。共价晶体。
纯净的SiO2光学性能好,可以制光导纤维、光学仪器等。
(1)酸性氧化物,与强碱反应。常温时强碱溶液与SiO2会缓慢反应生成硅酸盐,贮存强碱溶液的玻璃瓶不能用磨口玻璃塞(玻璃中含SiO2),否则会生成有黏性的硅酸钠盐,使瓶塞和瓶口黏结在一起。
SiO2+2NaOH=Na2SiO3+H2O
(2)与氢氟酸反应。氢氟酸可用来雕刻玻璃。
SiO2+4HF=SiF4↑+2H2O
(3)与碳反应制粗硅。
SiO2+2C=高温=Si+2CO↑
(4)可用于制玻璃。
SiO2+Na2CO3=高温=Na2SiO3+CO2↑
SiO2+CaCO3=高温=CaSiO3+CO2↑
3、H2SiO3,比碳酸弱的酸。在水溶液中生成时,易形成胶体,更浓时,会形成凝胶。晾干时,可用作干燥剂(硅胶),也可用作固体催化剂的载体。
(1)与强碱反应。
H2SiO3+2NaOH=Na2SiO3+2H2O
(2)受热易分解。
H2SiO3=Δ=SiO2+H2O
4、Na2SiO3,俗称泡花碱,水溶液叫水玻璃。用它浸泡过的木材有防火防腐性能。水解能力强,水溶液的碱性较强。
与很多酸能反应。
Na2SiO3+2HCl= H2SiO3↓+2NaCl
5、制硅
(1)SiO2+2C=高温=Si(粗硅)+2CO↑
(2)Si+3HCl=加热=SiHCl3+H2
(3)SiHCl3+H2=高温=Si(高纯硅)+3HCl
五、磷P
磷的主要矿物为磷灰石。氟磷灰石的化学式为Ca5(PO4)3F。
1、有白磷、红磷、黑磷等同素异形体。
(1)白磷的分子式为P4,正四面体结构,6个P-P键,在空气中易自燃,有剧毒。保存在水中。
红磷常温下稳定,无毒。磷是亲氧元素。
(2)与氧气反应生成P4O10或P4O6。
(2)在氯气中燃烧生成白烟,产物有两种,PCl3和PCl5。
(3)与强碱加热能发生歧化反应。如与NaOH反应
2P4+24NaOH=5Na3P+5Na3PO4+12H2O。
2、P2O5常温下是白色固体,有强烈的腐蚀性和毒性,有强吸水性,可用作强干燥剂。
(1)与冷水反应:
P2O5+H2O=2HPO3
与热水反应:
P2O5+3H2O=2H3PO4
(2)五氧化二磷对水有很强的亲和力,甚至可以使硫酸脱水。
P2O5+3H2SO4=2H3PO4+3SO3
3、H3PO4磷酸不易挥发,不易分解,几乎没有氧化性。
有一定的吸水性,可代替浓硫酸用作干燥剂,优点是无氧化性,可干燥HBr、HI、H2S等。
是三元弱酸,与NaOH反应能生成三种盐NaH2PO4、Na2HPO4、Na3PO4。
4、磷肥主要是指易溶于水的Ca(H2PO4)2等。
Ca3(PO4)2和CaHPO4难溶于水,不能当磷肥用。制造磷肥的反应为
Ca3(PO4)2+2H2SO4= Ca(H2PO4)2+2CaSO4。

- 全部评论(0)
