21-25号元素及其化合物知识要点简介
时间:2024-03-21 10:37 来源:未知 作者:张德金 点击: 次 所属专题: 元素化合物简介
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、钪Sc
1、单质是柔软、银白色。熔点1500℃以上。钪常用来制特种玻璃、轻质耐高温合金。
在空气中易被氧化,生成Sc2O3。
与热水能反应产生氢气。
在大多数稀酸中缓慢溶解。
2Sc+6HCl=2ScCl3+3H2↑
2、钪土Sc2O3,碱性氧化物。
3、盐类无色,与氢氧化钾和碳酸钠形成胶体沉淀。
碳酸盐Sc2(CO3)3不溶于水,在水溶液中能形成碱式碳酸盐沉淀。
ScCl3升华温度850℃,为离子化合物,易水解。
4、制取钪金属
电解熔化的ScCl3生产出来。
5、应用:
(1)钪钠灯具有发光效率高、光色好、节电、使用寿命长和破雾能力强等特点,使其广泛用于电视摄像和广场、体育馆、马路照明。
(2)用于太阳能光电池,在金属-绝缘体-半导体硅光电池和太阳能电池中,钪是最好的阻挡金属。
(3)用于γ射线源,46Sc可以当作γ射线源或者示踪原子,还可以用来对恶性肿瘤进行放射治疗。
(4)用于制造合金,在铝、铁、钨中加入少量,对合金起质变作用。
(5)用于改良特殊陶瓷,Sc2O3对氧化锆陶瓷材料有良好的稳定作用。对氮化硅有增密和稳定作用。
(6)用于催化剂,对有机化工有重要作用。
(7)用于核能工业,在高温反应堆核燃料中UO2加入少量Sc2O3可避免发生体积增大和出现裂纹。
(8)用于燃料电池,在镍碱电池中加入2.5%~25%的钪,会增加使用寿命。
二、钛Ti,宇航金属。
有+4、+3、+2等价态。
钛的矿石主要有钛铁矿(FeTiO3)及金红石(TiO2)。
1、新型重要应用金属。
(1)密度小,机械强度大,熔点高。在常温下,钛表面易生成一层极薄的致密的氧化物保护膜,可以抵抗强酸甚至王水的作用,表现出强的抗腐蚀性。
但与热的浓HCl和浓硫酸反应。
2Ti+6HCl(浓)=Δ=2TiCl3+3H2↑
2Ti+6H2SO4(浓)=Δ=2Ti2(SO4)3+3H2↑
Ti3+溶液显紫色。
与硝酸不反应,因为表面的致密氧化膜得到强化。
(2)难冶炼。在高温下,化学性质非常活泼。金属钛在高温环境中的还原能力强,能与氧、碳、氮以及其他许多元素化合。它是亲氧元素,能从氧化铝中夺取氧。
Ti+O2=高温=TiO2
3Ti+2Al2O3=高温=3TiO2+4Al
(3)亲生物性,无毒,广泛用于医疗,比如制造钛合金骨骼等。
2、TiCl4,在常温下是无色液体,遇湿即强烈水解,产生白烟。可用于制TiO2。
TiCl4+(x+2)H2O=TiO2·xH2O+4HCl
3、TiO2,又叫钛白,是重要的白色颜料,且无毒。化学性能稳定,可用于制造白色涂料、白色油漆、白色塑料、白纸等。
两性氧化物。
TiO2+H2SO4(浓)=Δ=TiOSO4+H2O
BaCO3+TiO2=熔融=BaTiO3+CO2↑
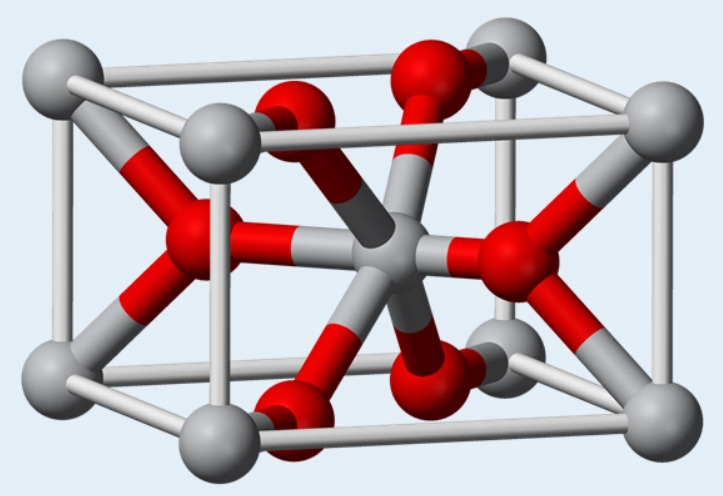
金红石结构
4、钛酸钡(BaTiO3)晶体,受压力而改变形状的时候,会产生电流,一通电又会改变形状。把钛酸钡放在超声波中,它受压便产生电流,由它所产生的电流的大小可以测知超声波的强弱。相反,用高频电流通过它,则可以产生超声波。绝大多数超声波仪器中,都要用到钛酸钡。
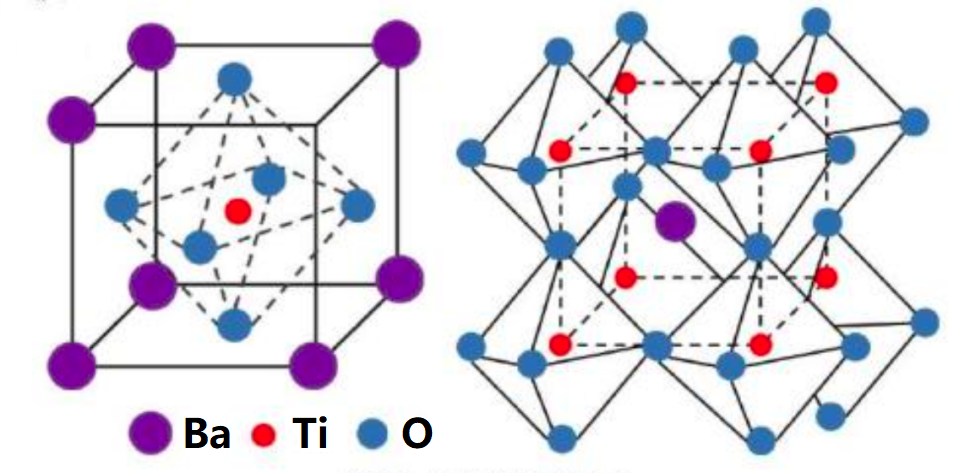
5、制取钛的流程
(1)FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
(2)Ti(SO4)2+3H2O=H2TiO3+2H2SO4
(3)H2TiO3=Δ= TiO2+H2O
(4)TiO2+2C+2Cl2=1000K=TiCl4+2CO
(5)镁还原法:2Mg+TiCl4=高温/惰性气体=Ti+2MgCl2
6、钛属于稀有金属。
稀有金属是在地壳中含量较少、分布稀散或难以从原料中提取的金属,如锂、铍、钛、钒、锗、铌、钼、铯、镧、钨、镭等。
按其物理、化学性质及生产方法上的不同可分为:
(1)稀有轻金属,如铍、锂、铷、铯等;
(2)稀有贵金属,如铂、铱、锇等;
(3)稀有分散金属,如镓、锗、铟、铊等;
(4)稀土金属,如钪、钇、镧、铈、钕等;
(5)难熔稀有金属,如钛、锆、钽、钒、铌等;
(6)放射性稀有金属,如钋、镭、锕、铀、钚等。
三、钒V
世界上已知的钒储量有98%产于钒钛磁铁矿。
有+5、+4、+3、+2等价态。+5价为最稳定,其次是+4价。
在钢中加入百分之几的钒,就能使钢的弹性、强度大增,抗磨损和抗爆裂性极好,既耐高温又抗奇寒,有金属“维生素”之称。
1、钒,灰黑色金属,熔点很高,为难熔金属,有延展性,质坚硬,无磁性。具有耐盐酸和硫酸的本领,并且在耐气、耐盐、耐水腐蚀的性能要比大多数不锈钢好。
(1)钒在高温下反应活性很高。在氧气中加热,氧化成绿色的VO,黑色的V2O3、蓝黑色的VO2,并最终成为砖红色的V2O5。
(2)钒在氮气中加热至900~1300℃会生成氮化钒。
(3)钒在真空下或惰性气氛中与碳、硅、硼、磷、砷一同加热时,可形成相应的碳化物、硅化物、硼化物、磷化物和砷化物。
2、氧化物:VO、V2O3、VO2、V2O5。
钒的氧化物已成为化学工业中最佳催化剂之一,有“化学面包”之称。
3、不同价态的钒离子有不同的颜色:VO2+颜色为黄色,VO2+颜色为蓝色,V3+为绿色,V2+为紫色。可以制造不同颜色的墨水。
NH4VO3难溶于水。

4、制取钒:
纯的金属钒一般是用K在高压下将V2O5还原而得到的。工业上也用Al、焦炭还原V2O5生产纯钒。
2V2O5+5C=高温=4V+5CO2↑
5、钒电池(全钒氧化还原液流电池)的主要优点:(1)功率大,改变电极面积和数量可扩展。(2)容量大,改变电解液容量可扩展。(3)效率高。(4)使用寿命长。(5)响应速度快。(6)可瞬间充电。(7)安全性高。(8)成本低。
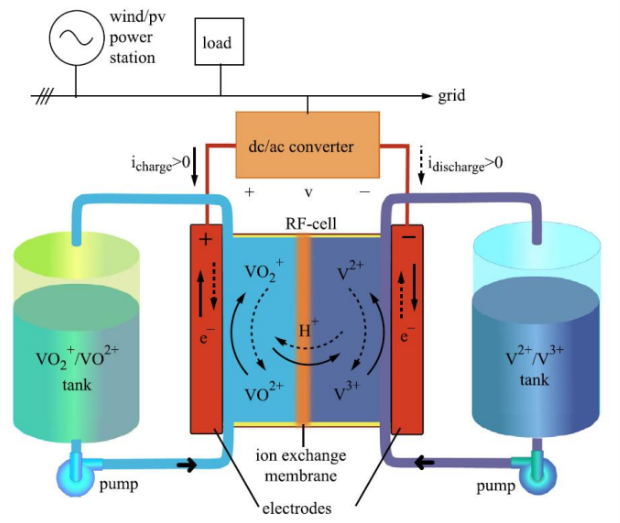

6、常见盐:偏钒酸铵NH4VO3、偏钒酸钠NaVO3、正钒酸钠Na3VO4、三氯氧钒VOCl3、硫酸氧钒VOsO4、四氯化钒VCl4等。
四、铬Cr
自然界中主要以铬铁矿FeCr2O4形式存在。常见价态有+6、+3、+2等。可用于制造不锈钢等。
1、单质是自然界硬度最大的金属,因为单电子多,金属键强。表面形成致密氧化物,化学性质稳定。
铬能慢慢地溶于稀盐酸、稀硫酸,而生成蓝色溶液(CrCl2)与空气接触则变成绿色,是因为被氧化成绿色的CrCl3。
Cr + 2HCl= CrCl2+H2↑
4CrCl2+4HCl+O2=4CrCl3+2H2O
(蓝色) (绿色)
铬与浓硫酸反应,则生成二氧化硫和硫酸铬(Ⅲ):
2Cr + 6H2SO4(浓)=Cr2(SO4)3+3SO2↑ + 6H2O
铬不溶于浓硝酸,表面生成紧密的氧化物薄膜而呈钝态。
在高温下,铬能与X2、O2、S、N2、C等直接化合。
2、CrO3、CrO2、Cr2O3、VO5
(1)CrO3又名铬酐,为深红色晶体。溶于水、硫酸、硝酸、乙醇等。

4CrO3=Δ=2Cr2O3+3O2↑
2CrO3=Δ/富氧=2CrO2+O2↑
(2)CrO2,磁粉,黑色固体。用于录音磁带、留声机唱片、记忆装置及永久磁铁的生产。还用作催化剂。
(3)Cr2O3为绿色晶体,又叫铬绿,有两性。

Cr2O3+6HCl=2CrCl3+3H2O
Cr2O3+2NaOH+3H2O=2Na[Cr(OH)4]
(4)VO5过氧化铬,蓝色。铬显+6价。
3、铬盐
(1)Cr(II)有Cr2+或Cr(OH)2或CrO,都有强还原性。(CH3COO)2Cr可用做吸氧剂。
(2)Cr(III)有Cr3+或Cr(OH)3或Cr2O3。
Cr3++3OH-=Cr(OH)3↓
生成灰蓝色沉淀。
(3)Cr2O72-存在于酸性溶液,显橙色。CrO42-存在于碱性溶液,显黄色。
Cr2O72-+2OH-=2CrO42-+H2O
2CrO42-+2H+=Cr2O72-+H2O

酸性条件下有较强的氧化性,产物为Cr3+,显绿色。
K2Cr2O7+14HCl=Δ=2KCl+2CrCl3+3Cl2↑+7H2O

4、制取铬
(1)铝还原法:
Cr2O3+2Al=Δ=Al2O3+2Cr
(2)电解铬钾矾K2SO4·Cr2(SO4)3·24H2O溶液。
5、Cr(VI)化合物有毒。
6、铬元素有助于胰岛素促进葡萄糖进入细胞内的效率,是血糖调节剂。
氧化铬用作耐光、耐热的涂料,玻璃、陶瓷的着色剂,化学合成的催化剂。
碱式硫酸铬用作皮革的鞣剂。
铬矾、重铬酸盐用作织物染色的媒染剂、浸渍剂及各种颜料。
镀铬和渗铬可使钢铁、铜、铝等形成抗腐蚀表层,光亮美观。
7、测定溶液中氯离子的方法:硝酸银滴定法
此法是在中性或弱碱性溶液中,以铬酸钾(K2CrO4)为指示剂,用硝酸银标准溶液滴定。
溶液中首先析出白色氯化银沉淀,当氯化银定量沉淀后,过量一滴AgNO3溶液即与CrO42-生成砖红色Ag2CrO4沉淀,到达滴定终点。反应如下:
2Ag++CrO42-= Ag2CrO4↓

五、锰Mn
锰矿有软锰矿MnO2、褐锰矿Mn2O3、黑锰矿Mn3O4、水锰矿MnO(OH)、硬锰矿rMnO·1MnO2·mH2O、菱锰矿MnCO3。

锰金属应用于钢铁领域。锰元素是一种营养元素,对植物也是。
1、单质是一种灰白色、硬脆的金属。纯净的金属锰比铁稍软。
锰铁是重要的铁合金。
(1)锰粉在空气中能燃烧,生成Mn3O4。同时与氮气生成少量Mn3N2。
3Mn+2O2=点燃=Mn3O4
3Mn+N2=点燃=Mn3N2
(2)锰粉在卤素单质,生成Mn(II)。
Mn+Cl2=点燃=MnCl2
(3)与热水反应。
Mn+2H2O=Δ=Mn(OH)2+H2↑
(4)溶于稀酸
Mn+H2SO4=点燃=MnsO4+H2↑
2、Mn(II):MnsO4(易溶)、MnCl2(易溶)、Mn(OH)2(难溶)、MnCO3(难溶)等形式存在,具有一定的还原性。固体均为白色至桃红色晶体。
Mn(OH)2在碱性环境中能与水中的氧气生成MnO(OH)2,在酸性环境中,MnO(OH)2又能将I-氧化为I2。上述过程可以测定水中的氧含量。
3、Mn3O4,黑色晶体。(含二价锰和三价锰)
用于软磁材料、半导体电子材料、三元电池材料、锰酸锂电池、磷酸铁锰锂电池材料、锌锰电池材料、以及玻璃等的制造。
3、MnO2,黑色固体。难溶于水、弱酸、弱碱、硝酸、冷硫酸。是两性氧化物,存在MnCl4和BaMnO3等。
用于制造干电池。有较强氧化性,能将浓盐酸氧化。
MnO2+4HCl(浓)=Δ=MnCl2+Cl2↑+2H2O
MnO2+2H2SO4=2MnsO4+O2↑+2H2O
它是双氧水和KClO3分解的催化剂。
4、K2MnO4,深绿色晶体,在强碱性溶液(pH大于13.5)中稳定,锰酸根离子的绿色可长期保持。在酸性、中性、弱碱性时,易发生歧化反应。
4H++3MnO42-= 2MnO4-+ MnO2↓+2H2O
2H2O+3MnO42-= 2MnO4-+ MnO2↓+4OH-
与盐酸反应产生氯气。
K2MnO4+8HCl=2KCl+MnCl2+2Cl2↑+4H2O
5、KMnO4,紫黑色晶体,水溶液呈紫色,有强氧化性,可以氧化很多无机物和有机物。
水溶液可以用作杀菌消毒剂。
一般与硫酸混合使用,产物为MnsO4。若在中性环境中,产物为MnO2,在碱性环境,产物为K2MnO4。
与乙烯反应:
(碱性环境)C2H4+12KMnO4+16KOH=2K2CO3+12K2MnO4+10H2O
(中性环境)C2H4+4KMnO4=2K2CO3+4MnO2↓+2H2O
(酸性环境)5C2H4+12KMnO4+18H2SO4=10CO2+6K2SO4+12MnSO4+28H2O
是最强的氧化剂之一,作为氧化剂受pH影响很大,在酸性溶液中氧化能力最强。
其相应的酸高锰酸HMnO4和酸酐Mn2O7,均为强氧化剂。
可制取氧气。
2KMnO4=Δ=K2MnO4+MnO2+O2↑
用KMnO4和浓盐酸可以制氯气。
2KMnO4+16HCl(浓)= 2KCl + 2MnCl2+8H2O + 5Cl2↑
6、铝热法制锰
4Al+3MnO2=高温=2Al2O3+3Mn

- 全部评论(0)
