强酸和弱酸(或强碱和弱碱)的比较
时间:2007-05-14 14:28 来源: 作者:李萱 点击: 次 所属专题: 强酸与弱酸比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(一)利用稀释过程中c(H+)或pH变化的不同进行比较:
[例1]将pH相同的盐酸和醋酸溶液分别稀释到原体积的m倍和n倍,稀释后两溶液的pH相同,m和n的关系是( )
A. m=n B. m>n
C. m<n D.无法确定
解析:盐酸和醋酸在稀释过程中c(H+)和pH的变化如下图:
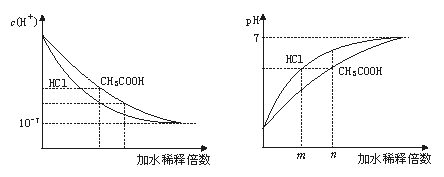
从图中可看出,稀释后溶液的pH仍然相同时,从稀释的倍数上看,盐酸比醋酸小,即m<n,应选C。
答案:C
[例2]将物质的量浓度相同的盐酸和醋酸溶液稀释到原体积的m倍和n倍,稀释后pH相同,m和n的关系是( )
A.m=n B.m>n
C.m<n D.无法确定
解析:物质的量浓度相同时,溶液中盐酸的H+浓度大于CH3COOH的H+浓度。盐酸和醋酸稀释过程中c(H+)和pH变化如下图:
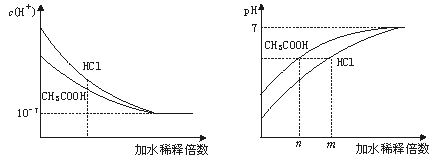
从上图可以看出,稀释后溶液的pH相同时,盐酸稀释的倍数比醋酸大,即m>n,应 选B。
答案:B
[例3]有两瓶pH=2的酸,一瓶是强酸,一瓶是弱酸。现只有石蕊试液、酚酞试液、pH试纸、蒸馏水,而没有其他试剂。简述如何用最简便的实验方法判别哪瓶是强酸?
解析:pH相同的酸溶液直接用指示剂是无法区别的。应将注意力集中于“蒸馏水”上,利用稀释前后pH的变化程度不同来进行判别,即各取等体积酸溶液,用蒸馏水稀释相同倍数(如100倍),然后用pH试纸分别测其pH,pH变化大的是强酸。
(二)利用跟金属反应的程度和速度不同进行比较。
[例4]向体积均为1升、pH均为2的盐酸和醋酸溶液中分别投入0.66克锌粉,下列哪组曲线变化较符合事实( )
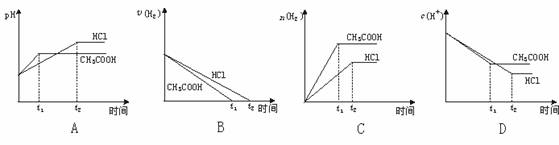
解析:应同时考虑锌分别与盐酸和醋酸反应的速率和程度。第一步,1升pH=2的盐酸提供H+的物质的量比1升pH=2的醋酸溶液提供的H+少。0.66克锌(约0.01 mol)对1升pH=2的盐酸来说,锌过量,对1升pH=2的醋酸来说,醋酸过量。因此,锌与醋酸反应产生H2的体积比较大,锌与醋酸反应后溶液中c(H+)比较大。
第二步,在整个反应过程中,随着反应的进行,两反应的速率均减小,但由于醋酸溶液中存在电离平衡 CH3COOH ![]() CH3COO-+H+,使H+浓度减小较缓慢,所以在同一时刻锌和醋酸反应的反应速率较快。
CH3COO-+H+,使H+浓度减小较缓慢,所以在同一时刻锌和醋酸反应的反应速率较快。
第三步,何者先停止反应?很难判断。估计锌与醋酸的反应可能先停止,尽管与醋酸反应时消耗的锌比较多,但整个反应过程中锌与醋酸反应得快。
基于上述综合性评价,比较符合事实的是选项C
答案:C
[例5]一定量的镁粉与稀硫酸反应,其速率特别快,难以控制。为了能较缓慢地收集氢气,又使产生氢气的量不减少,应向稀硫酸中加入 ,理由是__________________。
解析:①要使反应速率变慢,必须使溶液中c(H+)减小;②要使产生氢气的量不减小,酸最终提供H+的物质的量不能减少。综合①②知加入的物质应能使溶液中H+暂时储存起来,反应时又能逐步释放出来。
答案:(1)直接加水稀释 使溶液中c(H+)减小,但H+总数不变。
(2)加弱酸强碱盐(如CH3COONa)使其转化为弱酸,将溶液中的H+储存起来,并随时能释放出来(但不能加碳酸盐或碳酸氢盐等)。
(三)利用酸碱中和反应后溶液酸碱性的不同进行比较。
[例6](1)一种pH=2的酸溶液和一种pH=12的碱溶液等体积混合后所得的溶液呈酸性,其可能的原因是( )
(2)0.01 mol·L-1的某一元酸溶液和0.01 mol·L-1的某一元碱溶液等体积混合后所得溶液呈碱性,其可能原因是( )
A.强酸和强碱溶液反应
B.弱酸和强碱溶液反应
C.强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
解析:要考虑题中所述的酸是强酸还是弱酸,碱也如此。
①若pH=2的强酸溶液和pH=12的强碱溶液等体积混合,则所得溶液呈中性。
②若浓度各为0.01 mol·L-1的某一元强酸和某一元强碱溶液等体积混合,则所得溶液呈中性。
③若pH=2的强酸溶液和pH=12的弱碱溶液等体积混合,则因弱碱过量,所得溶液呈碱性。
④若浓度各为0.01 mol·L-1的某一元强酸和某一元弱碱溶液等体积混合,则因生成了强酸弱碱盐,其溶液呈酸性。
⑤若pH=2的弱酸溶液和pH=12的强碱溶液等体积混合,则因弱酸过量,所得溶液呈酸性,生成的盐是强碱弱酸盐。
⑥若浓度各为0.01 mol·L-1的某一元弱酸和某一元强碱溶液等体积混合,则因生成了弱酸强碱盐,其溶液呈碱性。
答案:(1)B (2)B

- 全部评论(0)
