“硝酸+金属”反应的多角度剖析
时间:2016-01-21 12:04 来源: 作者:彭琳 点击: 次 所属专题: 硝酸与金属
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、反应中硝酸由“浓”变“稀”
例1.向100mL18mol/L的浓HNO3中加入足量的铜片,充分反应后,被还原的硝酸的物质的量是()
分析:铜片与浓、稀HNO3发生反应的方程式为:
![]()
![]()
在反应过程中,浓硝酸逐渐变为稀硝酸,用极端假设法处理,若全按浓HNO3计算,答案为0.9mol;若全按稀HNO3计算,答案为0.45mol。事实上,应介于二者之间才符合题意。故选C。
二、反应中构成“![]()
例2.铜粉加入稀硫酸中,加热无明显现象发生,若加入一种盐溶液后,铜粉的质量减小,溶液显蓝色,同时有气体逸出,该盐是()
A.Fe2(SO4)3 B.Na2CO
分析:A项加入![]()
![]()
![]()
![]()
![]()
![]() ,把铜粉溶解,并放出NO气体。
,把铜粉溶解,并放出NO气体。![]()
三、具有可变化合价的金属与硝酸反应
例3.含n g HNO3的稀溶液,恰好使5.6g 铁粉完全溶解,若有n/4g 被还原成NO(无其他还原产物),则n值不可能是( )
A.12.6 B.16.8 C.18.9 D.25.2
分析:若氧化产物全是![]()
![]()
若氧化产物全是![]()
![]()
![]()
若氧化产物是![]() 与
与![]() 的混合物,则
的混合物,则![]()
四、硝酸还原产物的确定
例4.某条件下,锌与硝酸反应时物质的量之比为2:5,此时硝酸的还原产物是________。
分析:在反应过程中,锌全部转化成Zn(NO3)2,2mol Zn共失去4mol 电子,则1mol HNO3应得到4mol 电子,化合价降低4价,也就是说,在还原产物中氮元素的平均化合价为+1价,是N2O或NH4NO3(特别说明:NH4NO3中氮元素的平均化合价为![]()
![]()
![]()
五、图象分析
例5.铁在热的稀硝酸中反应,其主要还原产物为NO,当溶液变稀时,其主要还原产物是![]()
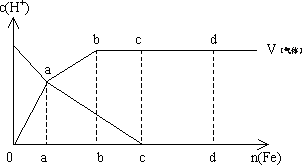
(1)假设有任一气体产生的曲线内只有一种还原产物,试配平由b点到C点时反应的化学方程式:□Fe+□HNO3=□Fe(NO3)2+□□+□H2O
(2)从0点到a点时的还原产物为_________。
(3)从a点到b点时还原产物为_________,其原因是_________。
(4)已知达到d点时,反应完全结束,此时溶液中的主要阳离子为_________。对应于C、D两点投入的金属铁的物质的量之比![]()
分析:首先分析图象,C点时,溶液中![]() 浓度最小,表明HNO3已全部耗完。
浓度最小,表明HNO3已全部耗完。![]()
![]()
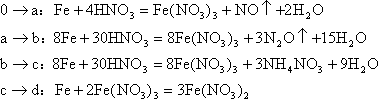
反应开始时![]() 段放出NO气体,随着反应过程的进行放出热量,体系温度升高且
段放出NO气体,随着反应过程的进行放出热量,体系温度升高且![]() 更稀,所以此后
更稀,所以此后![]() 被还原的程度更深,故
被还原的程度更深,故![]() 段放出的气体是N2O。反应结束时,溶液中的主要阳离子是
段放出的气体是N2O。反应结束时,溶液中的主要阳离子是![]()
![]() 。C、D两点投入的金属的物质的量之比为2:3。
。C、D两点投入的金属的物质的量之比为2:3。

- 全部评论(0)
