热点物质:倍受青睐的“硫酸氢钠”
时间:2020-03-05 18:52 来源: 作者:王宗峰 点击: 次 所属专题: 硫酸氢钠
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
硫酸氢钠是我们中学阶段学习的一种重要的强酸酸式盐,以其完全电离的强酸性成为高考命题的重要物质载体。
一、硫酸氢钠的性质
1、完全电离,强酸性:NaHSO4==Na++H++SO42-
可以与弱酸盐发生复分解反应:NaHSO4+NaHSO3==Na2SO4+SO2↑+H2O
NaHSO4+NaHCO3==Na2SO4+CO2↑+H2O
涉及离子方程式:H++HSO3-==SO2↑+H2O ;H++HCO3-==CO2↑+H2O
2、与BaCl2、Ba(OH)2反应:NaHSO4+BaCl2==NaCl+HCl+BaSO4↓
NaHSO4+Ba(OH)2==NaOH+H2O+BaSO4↓
涉及离子方程式:SO42-+Ba2+==BaSO4↓; H++SO42-+Ba2++OH-==BaSO4↓+H2O
如果Ba(OH)2少量,则方程式表示为:2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
二、典题回放:
1、向硫酸氢钠溶液中滴加氢氧化钡溶液,溶液的pH与生成的沉淀关系如图所示,正确的是:
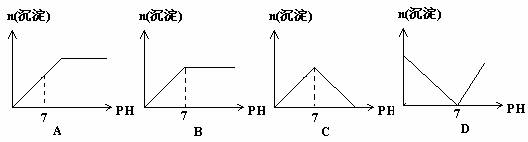
解析:向硫酸氢钠溶液中滴加氢氧化钡溶液,溶液达到中性时(2:1反应),SO42-还未沉淀完全,继续加入氢氧化钡溶液,当SO42-沉淀完全时(1:1反应),溶液已成碱性。随着氢氧化钡溶液的加入,硫酸钡沉淀不会消失。选A。
2、有两种无机盐A和B,其相对分子质量均为120,为了确定A和B,将他们分别溶于水制成溶液进行下列实验。①将两种溶液混合,立即产生一种易溶于水易液化的气体;②在两种溶液中分别加入BaCl2溶液,A溶液无沉淀产生,B溶液有白色沉淀产生;③在两种溶液中分别加入Ba(OH)2溶液均有白色沉淀产生。试推断A和B的化学式_______________
解析:两种盐混合产生易溶于水易液化的气体,由气体的明显特征推断是SO2,根据复分解反应原理,这两种盐为硫酸氢盐和亚硫酸(氢)盐,②③两步实验,两种盐与BaCl2、Ba(OH)2不同实验现象确定a为亚硫酸氢盐,最后根据相对分子质量均为120,推断a和b的化学式分别为KHSO3和NaHSO4。
3、A、B、C、D、E均为可溶于水的固体,组成他们的离子有
阳离子 | Na+ Mg2+Al3+Ba2+ |
阴离子 | OH- Cl- CO32- SO42- HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是
A ;B ;C ;D ;E 。
解析:本题A物质为焦点物质,与B、C、D都能生成白色沉淀,且沉淀能溶于E或盐酸,A为碳酸钠,E物质能溶解两种沉淀,一定具有酸性,为硫酸氢钠;④的反应有很鲜明的特征,B与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,则B、D一定生成两种沉淀,B为硫酸铝,D为氢氧化钡;剩下Mg2+和Cl-,C为MgCl2。
参考答案:Na2CO3、Al2(SO4)3、MgCl2、Ba(OH)2、NaHSO4
NaHSO4在历年高考题中先后重复出现,暗示了这种物质性质的独特性和多面性,关注它的诸多性质,会使我们在学习中增长必备的知识和能力。

- 全部评论(0)
