盐类水解规律及离子方程式的书写
时间:2022-08-05 17:49 来源:摘抄于因特网 作者:韩富军 点击: 次 所属专题: 盐类水解规律 盐类水解方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、盐类水解的四大规律
1. 什么离子水解?
根据盐类水解的定义,知盐类水解的关键是生成了弱电解质。由下图示可知。
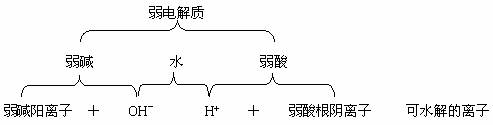
因此,盐中的弱离子(弱碱阳离子和弱酸根阴离子)一定要发生水解。
2. 什么盐水解?
强酸和弱碱所生成的盐叫强酸弱碱盐,强碱与弱酸所生成的盐叫强碱弱酸盐,弱酸与弱碱所生成的盐叫弱酸弱碱盐,强酸和强碱所生成的盐叫强酸强碱盐。
结论:含有弱离子的盐(强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐等三类盐)要水解,而不含有弱离子的盐(强酸强碱盐)不水解。
3.盐类水解后水溶液的酸碱性
(1) 强碱弱酸盐的水解
1) 强碱弱酸盐要水解,水解后水溶液显碱性;
2) 这类盐包括:K2CO3、Na2S、K2S、Na3PO4、NaH2PO4、NaHCO3、KHCO3、KAc、……
(2) 强酸弱碱盐的水解
1) 强酸弱碱盐要水解,水解后水溶液显酸性;
2) 这类盐包括:Cu(NO3)2、CuSO4、CuCl2、(NH4)2SO4、NH4Cl、NH4NO3、AlCl3、FeCl3……
(3) 弱酸弱碱盐要强烈水解,水解情况复杂。若生成的弱酸比弱碱强,则水溶液显酸性;若生成的弱碱比弱酸强,则水溶液显碱性,如(NH4)2CO3。若生成的弱酸与弱碱的强度相当,则水溶液显中性,如NH4Ac水解。
(4) 强酸强碱盐不水解,水溶液显中性。(即强酸与强碱发生中和反应彻底。)
故有: 盐 + 水 ![]() 酸 + 碱 (强酸强碱盐例外)。
酸 + 碱 (强酸强碱盐例外)。
这类盐包括:KNO3、NaNO3、KCl、Na2SO4、NaCl、……
4.水解离子方程式的书写
(1) 强碱弱酸盐
1) 弱酸根阴离子参与水解,生成弱酸或酸式弱酸根;
2) 多元弱酸根阴离子分步水解,(阴离子带几个电荷就要水解几步)水解离子方程式步步照写,水的系数始终是1。不过,第一步水解最易,第二步较难,第三步水解更难。
3) 水解离子方程式用“![]() ”,气体不能用“↑”号。
”,气体不能用“↑”号。
4) 通式:Am-+H2O![]() HA(m-1)-+OH-
HA(m-1)-+OH-
A-+H2O![]() HA+OH-
HA+OH-
(2) 强酸弱碱盐
1) 弱碱阳离子参与水解,生成弱碱;
2) 多元弱碱阳离子分步水解,水解离子方程式一步完成,水的系数为阳离子的电荷数;
3) 水解离子方程式用“![]() ”,弱碱不能用“↓”号。
”,弱碱不能用“↓”号。
4) 通式:Mn++nH2O![]() M(OH)n+nH+
M(OH)n+nH+
(3) 弱酸弱碱盐
弱酸根阴离子和弱碱阳离子都参与水解,反应后生成弱酸和弱碱。
通式:Mn++Am-+nm(OH)n+HnAH2O=mM
总结为:
弱水解,弱水解;
越弱越水解,两弱强水解。
酸碱性看“强”字,水解的离子看“弱”字。
门当户对:弱碱阳离子水解生成氢离子,弱酸根阴离子水解生成氢氧根离子。
二、水解离子方程式的书写方法
1.图示法
(1) Na2CO3
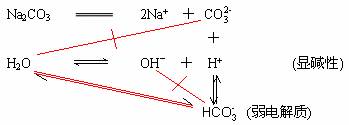
离子方程式为:![]() +H2O
+H2O![]()
![]() + OH-,
+ OH-,
相应的化学方程式为:Na2CO3+H2O![]() NaHCO3+NaOH。
NaHCO3+NaOH。
(2) NH4Cl
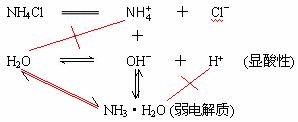
![]() + H2O
+ H2O![]() NH3·H2O + H+。
NH3·H2O + H+。
2.一般离子方程式的书写法
按照书写一般离子方程式的四个步骤进行。
如:NH4Cl
按照盐类水解是中和反应的逆反应,现写出化学方程式如下:
NH4Cl+ H2O![]() NH3·H2O + HCl
NH3·H2O + HCl
![]() + Cl- + H2O
+ Cl- + H2O![]() NH3·H2O + H+ + Cl-
NH3·H2O + H+ + Cl-
![]() + H2O
+ H2O![]() NH3·H2O + H+
NH3·H2O + H+
这里要注意多元弱酸生成的盐,水解生成碱和酸式盐。
如Na2CO3:
Na2CO3+H2O![]() NaHCO3+NaOH
NaHCO3+NaOH
2Na+ +![]() +H2O
+H2O![]() Na++
Na++![]() +Na+ +OH-
+Na+ +OH-
![]() +H2O
+H2O![]()
![]() +OH-
+OH-
3.缺啥补啥法
按照弱离子参与水解的原则,首先找出弱离子,弱离子与水反应生成对应的同电性的离子(氢离子或氢氧根离子),然后等式两边缺啥补啥,最后配平。
如CuSO4:参与水解的是Cu2+,生成对应的阳离子H+。
Cu2++H2O(H+·OH-)![]() ?+H+
?+H+
把水看成是H+·OH-,显然,阳离子将与结合生成Cu(OH)2,
Cu2++H2O(H+·OH-)![]() Cu(OH)2+H+,将其配平即得水解离子方程式:
Cu(OH)2+H+,将其配平即得水解离子方程式:
Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
又如 NaHCO3水解;参与水解的是,生成对应的阴离子OH-。
![]() +H2O(H+·OH-)
+H2O(H+·OH-)![]() ?+OH-
?+OH-
![]() 将OH-与结合生成H2CO3,可配平,可得下式:
将OH-与结合生成H2CO3,可配平,可得下式:
![]() +H2O(H+·OH-)
+H2O(H+·OH-)![]() H2CO3+OH-
H2CO3+OH-
4.通式法。这是最好,最死板的方法。
如Al2(SO4)3:
按照通式:Mn++nH2O![]() M(OH)n+nH+
M(OH)n+nH+
即可 得出:Al3++3H2O![]() M(OH)3+3H+
M(OH)3+3H+
又如Na3PO4:
按照通式:Am-+H2O![]() HA(m-1)-+OH-
HA(m-1)-+OH-
A-+H2O![]() HA+OH-
HA+OH-
即可得出:![]() +H2O
+H2O![]()
![]() +OH-
+OH-
![]() +H2O
+H2O![]()
![]() +OH-
+OH-
![]() +H2O
+H2O![]() H3PO+OH-
H3PO+OH-

- 全部评论(0)
