热重法离不开反应原理
时间:2022-07-05 10:48 来源:未知 作者:胡嘉谋 点击:次 所属专题: 热重曲线
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
热重法是在程序控温下测量易分解物质的质量随温度(或时间)的变化关系。热重曲线常以试样质量或残留率为纵坐标,横坐标为温度或时间绘成的定量曲线图。利用物质热重法分析的推断题,既需要定性分析又需要定量计算。由于解题过程常需要严谨的计算与分析,学生认为性价比不高,在考场上基本都是跳过,或是检查时匆匆蒙上一个答案,得分率很低。俗话说,一把钥匙开一把锁。此类问题要采取定性推测与定量验证来准确推断。定性推测:对热重图像中的易分解物质发生的分解反应原理进行分析判断,是失水过程,还是分解过程,甚至是在空气中灼烧生成不同价态氧化物的过程(有O2参与反应)等情况,初步确定产物的可能化学式。定量验证:对热重图像中的有关数据根据化学式进行计算,定量计算的方法一般有元素守恒、质量守恒、差量法等。请看示例。
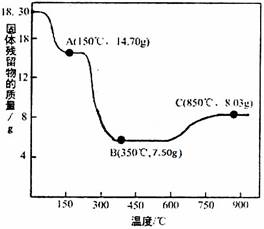
18.30g/183g·mol-1=14.70g/MA=7.50g/MB,解得MA=147g·mol-1,
MB=75.0g·mol-1,恰为CoC2O4、CoO的摩尔质量,故A、B分别为CoC2O4、CoO。
X∶Y=7.5/75∶[7.5/75+(8.03﹣7.50)/16)]=0.1∶0.133=3∶4,
故C为Co3O4或CoO·Co2O3。
例2.Co在化合物中呈现的价态类似于铁。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知290℃时Co(OH)2已完全脱水,则1000℃时,剩余固体的成分为________(填化学式);在290~500℃范围内,发生的反应的化学方程式为_______。在350~400℃范围内,剩余固体的成分为
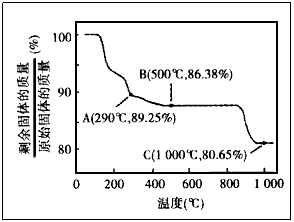
若剩余固体若为CoO(M=75),则固体残留率75/93=0.8065(C点);
若剩余固体若为Co2O3(M=166),则固体残留率为166/(2×93)=0.8925(a点);若剩余固体若为Co3O4(M=241),则固体残留率为241/(3×93)=0.8638(B点)。显然,1000℃时,剩余固体C的成分为CoO。在290~500℃范围内,AB段发生反应是Co2O3生成Co3O4。
 4CO3O4+O2↑
4CO3O4+O2↑
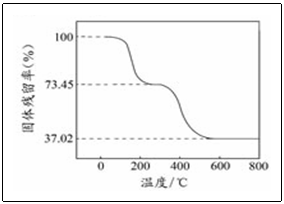
n(CO2)=0.560L/22.4mol·L
无水物分解生成的CO2与H2O的质量m(CO2)+m(H2O)=3.390g×(0.7345﹣0.3702)=1.235g m(H2O)=1.235g﹣1.10g=0.135g n(H2O)=0.135g/18g·mol-1=7.50×10-3mol,n(OH-)=1.50×10-2mol,n(OH-) :n(CO32-)=1.50×10-2mol∶2.50×10-2mol=3∶5。
 )的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n的值。
)的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n的值。
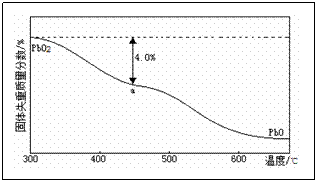
定性推测:样品失重的原因是分解生成了氧气,得到的a点固体为低价Pb的氧化物PbOx或mPbO2·nPbO。
定量验证:设PbO2为1mol,质量为239g,其中氧元素为2mol,失重为氧元素的质量,其物质的量为239g×4.0%/16g·mol-1≈0.6mol,
x=2﹣0.6=1.4。根据mPbO2·nPbO中的O、Pb元素守恒知:
(2m+n)/(m+n)=1.4∶1,解得m∶n=2∶3。
例5.CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料。CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示。
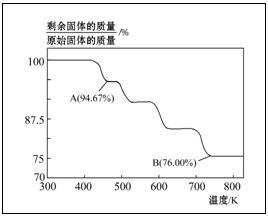
请回答下列问题:
(1)B点时剩余固体的化学式是______。
(2)加热至A点时反应的化学方程式为_____________________________。
定性推测:CrO3加热后失重为氧元素质量,A点、B点氧化物均为CrXOY。
定量验证:设CrO3的质量为100g,则B点剩余固体的质量为76g,知氧元素的质量差为24g。CrO3中的铬与氧元素的质量比为52∶48,则B点CrXOY中的铬与氧元素的质量比变为:52∶24,X∶Y=52/52∶24/16=2∶3,B点时剩余固体的化学式为Cr2O3。A点剩余固体的质量为94.67g,知氧元素的质量差为5.33g,则A点CrXOY中的铬与氧元素的质量比为:
52∶(94.67﹣52)=52∶42.67,X∶Y=52/52∶42.67/16=3∶8,A点时剩余固体的化学式为Cr3O8。
(1)Cr2O3 (2)6CrO3 2Cr3O8+O2↑
2Cr3O8+O2↑
四、其它物质的热分解
例6.右图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A、B物质的化学式分别是______。
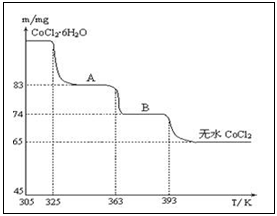
定性推测:CoCl2·6H2O晶体受热经A、B两步脱水,最后变为无水CoCl2。
定量验证:由于起始质量不知道,根据产物CoCl2的质量计算。设A、B的化学式分别为CoCl2·nH2O、CoCl2·mH2O,由钴元素守恒得:
65/130=83/(130+18n)=74/(130+18m),解得n=2,m=1,故A、B的化学式分别为:CoCl2·2H2O、CoCl2·H2O。
现场训练:
1.下图是100mgCaC2O4·H2O受热分解时所得固体产物的质量随温度变化的曲线。试用图中信息结合所学知识,回答下列问题:
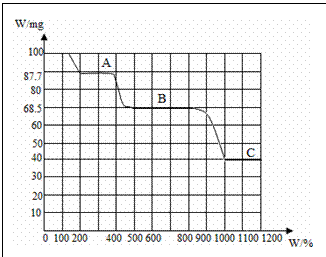
(1)推断CaC2O4·H2O持续受热所得固体产物A、B、C的化学式。
(2)写出由A受热反应得到B的化学方程式。
2.下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(T)变化的曲线(已知草酸锰不稳定,但其中锰元素的化合价在300
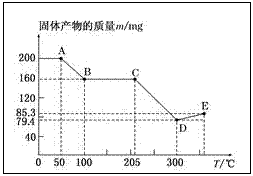
试回答下列问题:
(1)写出B点固体产物的化学式:_______。
(2)从B点到C点过程中固体物质质量不变的原因是________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:__
(4)从D点到E点过程中固体物质质量增加的原因是___
3.8.34g
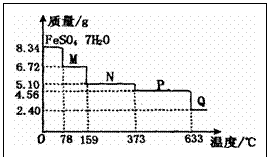
A.温度为78℃时固体物质M的化学式为FeSO4·5H2O
B.温度为L59℃时固体物质N的化学式为FeSO4·3H2O
C.在隔绝空气条件下由N得到P的化学方程式为FeSO4 FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
4.0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。
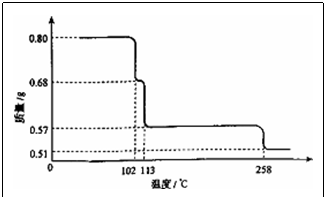
请回答下列问题:
(1)试确定200℃时固体物质的化学式_____(要求写出推断过程)。
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为___,其存在的最高温度是______。
参考答案:
1.(1)固体产物A、B、C的化学式分别是CaC2O4、CaCO3、CaO。
(2)由A受热反应得到B的化学方程式为CaC2O4 CaCO3+CO↑
CaCO3+CO↑
2.(1)MnC2O4
(2)MnC2O4在100~205℃时较稳定
(3)产物为MnO,其相对分子质量为71
(4)MnO与空气中的O2发生化合反应,生成新的锰的氧化物
3.D
4.(1) CuSO4·H2O
推断过程:设200℃时固体物质的化学式为CuSO4·(5﹣n)H2O,根据铜元素守恒知0.80/250=0.57/(160+90﹣18n),解得n=4,故200℃时固体物质的化学式为CuSO4·H2O。
(2) CuO+SO3↑
CuO+SO3↑
晶体为CuSO4·5H2O;其存在的最高温度是102℃。

- 全部评论(0)
(2227463492) 评论 热重法离不开反应原理:十分十分的感谢。
