绝热体系中化学平衡的定性分析
时间:2018-08-14 16:24 来源:未知 作者:胡嘉谋 点击: 次 所属专题: 绝热体系
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
所谓绝热就是指反应体系与外界没有热量交换,即热传递交换为0。实际上,绝热条件在化学平衡中的主要影响因素就是温度。因为几乎所有的化学反应均伴随着热能的释放与吸收,反应的吸、放热没有与外界交换,就影响着平衡体系中的温度变化,从而促使平衡发生移动。
例1.(2013·江苏卷15)一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L 恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1mol CO和1mol H2O,在II中充入1mol CO2和1mol H2,在III中充入2mol CO和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是(
CO2(g)+H2(g),其正反应放热。现有三个相同的2L 恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1mol CO和1mol H2O,在II中充入1mol CO2和1mol H2,在III中充入2mol CO和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是(
解析:这是一道考查学生对速率与平衡常数等概念的理解、对平衡移动和转化率等知识理解的难题。容器是恒容的绝热体系,与外界没有热量交换。容器I、III从正向开始反应达平衡,正反应是放热的,容器温度会升高。同时,容器III起始投料是容器I的两倍,故T3>T1>700℃,容器I、III中反应的平衡常数不相同:K1>K3,选项B错。容器II中从逆向开始反应达平衡,反应要吸热,容器温度会降低,即T1>700℃>T2。若是恒温,容器I和容器II完全等效,容器I中CO的转化率与容器II中CO2的转化率之和等于1,但由于是绝热体系,容器I升温,平衡左移,容器I中CO的转化率减小,CO的物质的量增多;而容器II降温,平衡右移,容器II中CO2的转化率减小,CO的物质的量减少,显然,容器I中CO的转化率与容器II中CO2的转化率之和小于1,选项D正确,容器I中CO的物质的量比容器II中的多,选项C正确。容器I、II中的温度不同,正反应速率也不同,容器I的反应速率要快,选项a错。
正确答案:CD
点评:绝热体系与外界没有热量交换,对化学平衡的影响就是温度的影响,只要化为改变温度使平衡移动,即可解决相关问题。
例2.(2011·天津卷6)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是(
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是(
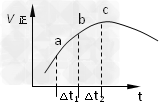
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a-b段小于b-c段
解析:这是一个反应前后体积不变的可逆反应,由于容器恒容并绝热,因此压强不影响反应速率,只考虑温度和浓度的影响。由图示信息可以看出随着反应的进行,c点前的v(正)逐渐增大,而c点后v(正)反而减小。c点前随反应物浓度的减小,v(正)应该降低,但此时v(正)还升高,说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高,v(正)加快。选项C错。c点后v(正)反而降低,说明此时反应物浓度的影响是主要的,随着反应物浓度越来越小,v(正)逐渐减小。但c点v(正)最大,c点后v(正)还在降低,说明c点未达平衡状态,选项A、B均错。v(正)越快,消耗的二氧化硫就越多,选项D正确。
正确答案:D
例3.(2012·福建卷23节选)在恒容绝热(不与外界交换能量)条件下进行,2A(g)+B(g)2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:
物 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
解析:这是一个反应前后体积有变化的可逆反应(注意D为固态),恒容绝热反应达到平衡后,体系压强升高,说明气体体积变大,反应向左进行达到平衡。由于温度与压强成正比,压强升高,温度升高,说明逆反应是吸热反应,正反应是放热反应。因此,可推知该反应的平衡常数与温度成反比关系或平衡常数随温度升高而减小。
现场体验:
1.(2014•凉山州三模)在绝热、恒容的密闭容器中进行反应2NO(g)+2CO(g) 2CO2(g)+N2(g)。下列示意图正确且能说明反应在进行到t1时刻达到平衡状态是(
2CO2(g)+N2(g)。下列示意图正确且能说明反应在进行到t1时刻达到平衡状态是(
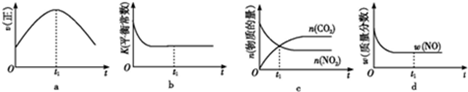
A.ab
2.(2008·广东卷8)将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g) ΔH<0,平衡时
2HBr(g) ΔH<0,平衡时
3.(2012·重庆卷13)在一个不导热的密闭反应器中,只发生两个反应:  2c(g)
2c(g)  2z (g)
2z (g)
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是(

- 全部评论(0)
