与核外电子排布有关概念辨析
时间:2021-12-17 09:10 来源:未知 作者:胡嘉谋 点击: 次 所属专题: 核外电子排布
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在学习《物质结构与性质》选修时,学生未注意区分辨析好与电子排布的有关概念,就会经常出现元素推断失误、化学用语表达错误、简答填空不准确等诸多方面的解题问题,而且屡屡犯错。为此,笔者作以下概念辨析,以供借鉴。
1.电子云。
它是电子在原子核外单位体积内出现概率的大小,是核外电子运动状态的形象化描述。电子云图中小黑点的疏密表示电子在原子核外单位体积内出现的概率大小。
2.电子层又称能层。
它是描述原子核外电子离核的远近,n(决定原子的电子层数)。n=1、2、3、4、5、6、7等电子层分别为K、L、M、N、O、P、Q等符号表示。能层与电子能量有关,决定着电子能量的高低。
3.原子轨道。
它是描述原子中单个电子的空间运动状态,每个原子轨道由电子层、能级、电子的运动空间形状和伸展方向共同描述。原子轨道分别为S、P、D、F轨道。
4.能级又称电子亚层。
它是描述原子轨道的形状,如S、P等轨道具有不同形状电子云分别呈球形、纺锤形(或哑铃形)等。相同亚层中的原子轨道(电子运动空间的形状相同)有不同的空间伸展方向,决定该种原子轨道的个数,如S-1,P-3,D-5,F-7。能级与电子能量有关,同一能层中不同形状的轨道具有不同的能量。但同一能层中的不同伸展方向的能级具有相同的能量。
5.电子自旋。
它是描述处于同一轨道的电子只分为顺时针和逆时针两种,它只代表电子的两种不同状态。
6.原子核外电子的运动状态。
它是由该电子所处的电子层、原子轨道的形状、原子轨道的伸展方向、电子自旋等四个方面决定。原子核外电子的运动状态数即为原子序数。如原子序数为19的钾原子核外电子有19种不同运动状态。
7.最外层电子、次外层电子、倒数第三层电子、内层电子、最内层电子等。
顾名思义,按有关概念名称理解。即:最外层电子是指原子结构示意图中最外面的一层电子。次外层电子是指原子结构示意图中外数第二层的电子。倒数第三层电子是指原子结构示意图中外数第三层的电子。内层电子是指原子结构示意图中除最外层外的内层电子。最内层电子是指原子结构示意图中第一层的电子。如Fe原子的电子层排列分别是2、8、14、2,其中最外层电子数是2,次外层电子数是14,倒数第三层电子数是8,内层电子数是24,最内层电子数是2。
8.外围电子、外层电子、价电子、价层电子等。
外围电子与外层电子定义相同,是指最后排入一个能级组上的电子,或称为原子核外最高能级组上的电子。外围电子与价电子概念不同,外围电子包括成键电子和非成键电子。
价电子与价层电子定义类似,价电子又称为特征电子,是指决定化学性质的电子,或认为能决定元素化合价的电子,或认为化学反应中可以失去的电子,或认为原子核外电子中能与其他原子相互作用形成化学键的电子。对于主族元素来说:价电子等于最外层电子等于外围电子,它们是一个概念。如S原子的价电子排布为3s23p4。对于副族元素来说:在高中范围内,价电子等于最外层电子(4S电子)与次外层的部分电子(3D电子)之和,即等于外围电子。如Fe原子的价电子排布为3d64s2。价电子所处的能级称为价电子层。
在一种化合物中,价层电子数除了中心原子的价电子外,还包括与中心原子键合的周围原子的电子。如CO2中C原子的价电子为4,价层电子数为8。
9.s、p、d、f电子、单电子、未成对电子、成对电子、共用电子、成键电子、孤对电子等。
在s、p、d、f轨道上的电子称为s、p、d、f电子。单电子与未成对电子的意思是一样的,单电子是指不成对的电子,即单独占据一个轨道的单电子。如n(原子中有)3个未成对电子。成对电子即一个轨道占据2个电子。如N原子中有2对成对电子。成对电子包含成键电子、共用电子、孤对电子等。共用电子就是成键电子,指的是位于两个原子之间共有的电子。孤对电子是没有成键的自旋方向相反的两个电子。如水分子中含有2对成键电子与2对孤对电子。与这些概念相对应的就有成对电子对数、价层电子对数、共用电子对数、孤电子对数、自旋相反的电子对数等说法。
10.微粒(原子、离子)结构示意图、电子式、电子排布式、价电子排布式、轨道表示式或轨道表示图或电子排布图等。
结构示意图:直观反映原子或离子核内的质子数和核外的电子层数及各能层上的电子数的图示。如S原子、Na+离子、O2-离子结构示意图分别如下:
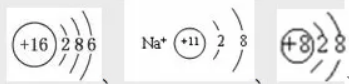
电子式:化学中常在元素符号周围用小黑点“·”或小叉“×”来表示元素原子最外层电子的式子。用电子式可以表示原子、离子、单质分子,也可以表示共价化合物、离子化合物及其形成过程。如S原子、Na+离子、O2-离子、N2分子、H2O分子、氯化钠及其形成过程等用电子式分别如下:
![]()
![]()
电子排布式:直观反映核外电子的能层、能级、各能级上电子数的式子。如Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2。
价电子排布式:直观反映基态原子的能层数和参与成键的电子数以及最外层电子数的式子。如Fe原子的价电子排布式为3d64s2。
轨道表示式或轨道表示图或电子排布图是同一种式子。它能直观反映各轨道的能量的高低及各轨道上的电子分布情况与自旋方向。如N原子的轨道表示式:
![]()
【练习巩固】
1.基态钠原子核外电子云有 个伸展方向,L能层轨道数为 。基态钾原子核外电子占据能级数为 ,M能层电子数为 。在第四周期中,最外层只有1个电子的元素有______种。
1.4、4、6、8、3
2.基态磷原子中存在 种不同能量的电子,原子核外有 个不同运动状态的电子,原子轨道数为 。基态磷原子中电子所处的最高能层符号为 ,其电子云在空间有 个方向,原子轨道呈 形。第四周期基态原子未成对电子数与磷相同的元素有 种。
2.5、15、9、M、3、纺锤、3
3.铁元素基态原子核外有 个电子云伸展方向,该原子的价电子排布式为 ,该原子中含有 种能量不同的电子,该元素+3价离子的未成对电子数为 。
3.9、3d64s2、7、5
4.NH4+的立体构型为 ,中心原子未成对电子数为 ,价层电子对数目为 。前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有______种。
4.正四面体、3、4、5
5.铬元素基态原子的价电子排布图为 ,能量最高的电子占据的能级有 种电子云伸展方向,该原子中成对电子数为 ,未成对电子数为 。
5.![]() 、5、9、6
、5、9、6
6.基态硼原子核外有 对自旋方向相反的方向。硼酸(H3BO3)中,硼和氧原子构成的空间构型是 ,硼原子价层电子对数为 。三氟化硼(BF3)中,孤电子对数为 。
6.2、平面三角形、3、9
7.钛元素基态原子的电子排布式为 ,其中未成对电子数为 ,能量最高的电子占据的能级符号为 ,该能级所在能层具有的原子轨道数为 。
7.1s22s22p63s23p63d24s2或[Ar]3d24s2、2、3d、9

- 全部评论(0)
