物质结构说理题之熔沸点问题
时间:2020-02-24 14:43 来源:未知 作者:化学自习室 点击:次 所属专题: 物质结构说理题 熔沸点
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、氯化铝的熔点为190℃,而氟化铝的熔点为1290℃,导致这种差异的原因为
【答】AlCl3是分子晶体,而AlF3是离子晶体。
2、P4O10的沸点明显高于P4O6,原因是:
【答】都是分子晶体,P4O10的分子间作用力高于P4O6
3、H2S熔点为-85.5℃,而与其具有类似结构的H2O的熔点为0℃,极易结冰成固体,二者物理性质出现此差异的原因是:
【答】H2O分子之间极易形成氢键,而H2S分子之间只存在较弱的范德华力。
4、二氧化硅的熔点比CO2高的原因:
【答】CO2是分子晶体,SiO2是原子晶体。
5、CuO的熔点比CuS的高,原因是:
氧离子半径小于硫离子半径,所以CuO的离子键强,晶格能较大,熔点较高。
6、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,原因是:
【答】邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛形成分子间氢键,分子间氢键使分子间作用力更大。乙二胺分子(H2N—CH2—CH2—NH2)中氮原子杂化类型为sp3,乙二胺和三甲胺n(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是:
【答】乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 。
7、丙酸钠(CH3CH2COONa)和氨基乙酸钠均能水解,水解产物有丙酸(CH3CH2COOH)和氨基乙酸(H2NCH2COOH),H2NCH2COOH中n(原子的杂化轨道类型为)sp3杂化,C原子的杂化轨道类型为sp3、sp2杂化。常温下丙酸为液体,而氨基乙酸为固体,主要原因是:
【答】羧基的存在使丙酸形成分子间氢键,而氨基乙酸分子中,羧基和氨基均能形成分子间氢键。
8、NH3常用作制冷剂,原因是:
【答】NH3分子间能形成氢键,沸点高,易液化,汽化时放出大量的热,所以能够做制冷剂。
9、比较下列锗卤化物的熔点和沸点,分析其变化规律及原因:
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | −49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
【答】GeCl4、GeBr4、GeI4的熔沸点依次上升。因为都是分子晶体,其组成和结构相似的物质,随分子量增大,范德华力增大,熔沸点上升。
10、东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。氨的沸点(“高于”或“低于”)膦(PH3),原因是:
【答】③高于 氨气分子间存在氢键,分子间作用力强
11、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是:
【答】GaF3是离子晶体,GaCl3是分子晶体,离子键比范德华力强
12、A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题(2)单质A有两种同素异形体,其中沸点高的是(填分子式),原因是:
【答】O3都是分子晶体,O3的相对分子质量大,范德华力大,沸点高。
13、乙酸的沸点明显高于乙醛,其主要原因是:
【答】CH3COOH存在分子间氢键
14、硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:
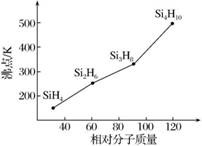
【答】同是分子晶体,硅烷的相对分子质量越大,分子间范德华力越强(或其他合理答案)
15、硝酸和尿素的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:
【答】尿素分子间存在氢键,使其熔沸点升高,而硝酸分子内存在氢键,使其熔沸点降低
16、氮化铝熔点22000C,其晶体类型是,氮化硼的熔点比氮化铝高,其原因是:
【答】 同为原子晶体,硼原子半径小于铝原子半径,氮化硼中共价键键能较大

- 全部评论(0)
