物质结构说理题汇总
时间:2020-02-24 14:41 来源:未知 作者:化学自习室 点击:次 所属专题: 物质结构说理题
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是砷原子半径较大,原子间形成的σ键较长,p-p轨道肩并肩重叠程度较小或几乎不能重叠,难以形成π键。
AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小。
2、乙酸的沸点明显高于乙醛,其主要原因是CH3COOH存在分子间氢键
3、在乙醇中的溶解度H2O大于H2S水分子与乙醇间能形成分子间氢键。
4、硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是:C—C键和C—H键较强,所形成的烷烃稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成
5、SO3的三聚体环状结构如图1所示,此氧化物的分子式应为________,该结构中S—O键长有a、b两类,b的键长大于a的键长的原因:
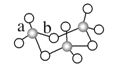
形成b键的氧原子与两个S原子结合,作用力较小(相当于一心两用)
6、碳元素可形成多种结构和性质不同的单质,其中金刚石的熔点为3550 ℃,C60的熔点约为280 ℃,导致这种差异的原因:金刚石是原子晶体,C60是分子晶体,前者原子间是靠强烈的共价键结合的,后者分子间是靠微弱的范德华力结合在一起的
7、Mn2+的稳定性强于Mn3+,其原因是:Mn2+的3d能级为半充满状态而Mn3+不是
8、已知常温下,H2CrO4的K1=4.1、K2=1×10-5,从结构的角度上看,K2<<K1的原因是:第二步电离产生的二价酸根离子重新结合H+的能力强于第一步电离产生的一价酸根离子结合H+的能力
9、OF2 分子中氧原子的轨道杂化类型为sp3杂化,OF2被称为氟化物而不被称为氧化物的原因是氧化物中氧元素显负价,而在OF2中氧元素的化合价为+2
10、从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是Fe3+的3d5半满状态更稳定
11、Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是:N元素电负性比O元素电负性小,N原子提供孤电子对的倾向更大,与Co2+形成的配位键更强
12、钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因:Ti的价电子数比Al多,金属键更强(或Ti的原子化热比Al大,金属键更强等其他合理答案)
13、C2H6和N2H4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键
14、H2O在乙醇中的溶解度大于H2S,其原因是:水分子与乙醇分子之间存在氢键
15、H2Te比H2S沸点高的原因是:两者均为分子晶体且结构相似,H2Te相对分子质量比H2S大,分子间作用力更强
16、硝酸易溶解于水的原因:硝酸分子是极性分子,易溶于极性溶剂的水中,硝酸分子中存在“H—O”键,易与水分子间形成氢键
17、HClO2和HClO3哪个酸性更强,为什么?HClO2和HClO3可分别表示为(OH)ClO和(OH)ClO2,HClO2中的Cl为+3价,而HClO3中的Cl为+5价,HClO3中Cl的正电性更高,导致Cl—O—H中O原子上的电子更向Cl偏移,更易电离出H+,故HClO3的酸性更强
18、请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量:N60>C60>Si60,其原因是:结构相似的分子晶体,相对分子质量越大,分子间作用力(或范德华力)越强,熔点越高,故熔点:Si60>N60>C60;而破坏分子需断开化学键,N—N键、C—C键、Si—Si键键长逐渐增大,键能逐渐减小,故破坏分子需要的能量顺序为N60>C60>Si60
19、四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是:均为分子晶体,范德华力随相对分子质量增大而增大
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性减弱、共价性增强。
20、CuSO4的熔点为560 ℃,Cu(NO3)2的熔点为115 ℃,CuSO4熔点更高的原因是:CuSO4和Cu(NO3)2均为离子晶体,SO所带电荷数比NO多,故CuSO4晶格能较大,熔点较高
21、氨(NH3)的熔、沸点比联氨(N2H4)低的主要原因:联氨分子间形成的氢键数目多于氨分子间形成的氢键
22、NH3容易与Cu2+形成配离子,但NF3不易与Cu2+形成配离子,其原因是:F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配位键
23、MgCl2的熔、沸点比BeCl2高的原因是:MgCl2是离子晶体,而BeCl2是分子晶体,发生状态变化时,离子晶体要克服离子键,分子晶体要克服分子间作用力,离子键比分子间作用力强得多
24、H3O+中H—O—H键角比H2O中H—O—H键角大,原因是:H2O中的氧原子有2对孤电子对,H3O+中氧原子有1对孤电子对,排斥力较小。
已知H2O 、NH3 、CH4三种分子中,键角由大到小的顺序是 CH4>NH3>H2O,请分析可能的原因:CH4分子中无孤对电子,NH3分子中含有1对孤对电子,H2O分子中含有2对孤对电子,对成键电子对的排斥作用依次增大,故键角逐渐减小。
NF3的键角___<___NH3的键角(填“>”“<”“=”),理由是:F的电负性比H大,NF3中N周围电子云密度减小,成键电子对之间的排斥力较小,因而键角较小。
两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6o和107o ,试分析PH3的键角小于NH3的原因: 电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的斥力增大,键角变大。
25、高温陶瓷材料Si3N4 晶体中键角N—Si—N __>__ Si—N—Si(填“>”“<”“=”),原因是:N原子上有孤电子对,由于孤电子对与成键电子对的排斥力更大,使得Si—N—Si键角较小。
26、某同学书写基态铜原子的价层电子排布式为3d94s2,该排布式违背了洪特规则特例。简单金属离子在水溶液中的颜色大多与价层含有未成对电子有关,Cu+呈无色,其主要原因可能是 价层无未成对电子 。
27、NaBrO、 NaBrO2、NaBrO3、NaBrO4 四种钠盐中,Br的杂化方式均为 SP3 杂化,阴离子空间构型为三角锥形的是 NaBrO3 (填化学式)。上述四种钠盐对应的酸的酸性依次增强,试解释HBrO4 的酸性强于HBrO3 的原因:HBrO3 和HBrO4 可分别表示为(HO)BrO2和(HO)BrO3 ,HBrO3 中Br为+5价而HBrO4 中Br为+7价。后者正电性更高,导致H、O之间的电子对向O偏移,更易电离出H+ 。
28、乙二胺分子(H2N—CH2—CH2—NH2)中氮原子杂化类型为 SP3 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是 乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键 。
28、碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
阳离子半径/pm | 66 | 99 | 112 | 135 |
试分析随着阳离子半径的增大,碳酸盐的分解温度逐步升高的原因: 碳酸盐分解过程实际上是晶体中的金属阳离子结合CO32- 中的氧离子,使CO32- 分解为CO2 的过程,所以当阳离子所带电荷数目相同时,阳离子半径越小,其结合氧离子的能力就越强,对应的碳酸盐就越容易分解 。
29、某同学用硫酸铜溶液与氨水做了一组实验,向硫酸铜溶液中滴加氨水生成蓝色沉淀,继续滴加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因: 乙醇分子极性比水分子弱,加入乙醇后溶剂的极性减弱,溶质的溶解度减小。
30、比较Mn和Fe的电离能数据可知:气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:Mn2+的3d轨道电子排布为半充满状态,较稳定;而Fe2+的3d轨道电子数为6,不是较稳定的状态。
31、检验K元素的方法是焰色试验,请用原子结构的知识解释产生此现象的原因:当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态电子,电子从能量较高的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量。
32、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,原因是:邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛形成分子间氢键,分子间氢键使分子间作用力更大。
33、HF和HCl在水中的溶解度 HF 较大,原因是:HF与水分子之间能形成氢键,氢键的存在能增强物质在水中的溶解性,所以HF和HCl在水中HF的溶解度较大。
34、金属铜单独与氨水或单独与过氧化氢都不反应,但可与氨水和过氧化氢的混合溶液反应,其原因是:过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行。
35、Si、C和O的成键情况如下:
化学键 | C—O | C=O | Si—O | Si=O |
键能(kJ·mol-1) | 360 | 803 | 464 | 640 |
C和O之间易形成含有双键的CO2分子晶体,而Si和O之间则易形成含有单键的SiO2原子晶体,请结合数据分析其原因为:碳与氧之间形成含有双键的分子晶体放出的能量(803kJ·mol-1 ×2=1606kJ·mol-1)大于形成含单键的原子晶体放出的能量(360kJ·mol-1 ×4=1440kJ·mol-1),故CO2易形成含双键的分子晶体;硅与氧之间形成含有双键的分子晶体放出的能量(640kJ·mol-1 ×2=1280kJ·mol-1)小于形成含单键的原子晶体放出的能量(464kJ·mol-1 ×4=1856kJ·mol-1),故SiO2易形成含单键的原子晶体。
36、尿素[CO(NH2)2]分子中N、O元素的第一电离能N>O,原因是: N元素的2P能级为半充满,是较稳定的结构,失去1个电子需要的能量多,所以第一电离能N>O
37、丙酸钠(CH3CH2COONa)和氨基乙酸钠均能水解,水解产物有丙酸(CH3CH2COOH)和氨基乙酸(H2NCH2COOH),H2NCH2COOH中N原子的杂化轨道类型为 SP3 杂化,C原子的杂化轨道类型为SP3 、SP2 杂化。常温下丙酸为液体,而氨基乙酸为固体,主要原因是: 羧基的存在使丙酸形成分子间氢键,而氨基乙酸分子中,羧基和氨基均能形成分子间氢键。
38、NH3常用作制冷剂,原因是:NH3分子间能形成氢键,沸点高,易液化,汽化时放出大量的热,所以能够做制冷剂。
39、Na+和Ne互为等电子体,电离能I2(Na) > I1(Ne),原因是:Na+和Ne电子排布结构相同,而Na+比Ne的核电荷数大,因此Na+原子核对核外电子的吸引力大于Ne原子核对核外电子的吸引力,所以Na+更难失去电子,电离能更大。
40、已知硼酸(H3BO3)是一元酸,解释其原因:H3BO3与一个水分子可形成配位键,产生[B(OH)4]- 和一个H+ 。

- 全部评论(0)
(357926658) 评论 物质结构说理题汇总:楼主很认真
(357926658) 评论 物质结构说理题汇总:楼主很认真
(357927698) 评论 物质结构说理题汇总:太优秀了^O^^O^
(3058982956) 评论 选修三简答题汇总:太感谢了!
(3058982956) 评论 选修三简答题汇总:太感谢了!
