关于原子、离子半径比较的那些事
时间:2019-07-23 16:48 来源:未知 作者:张劲辉 点击: 次 所属专题: 半径比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、我们的思维
我们中学老师一般会总结如下方法来比较微粒半径的大小:
三看比较原子离子半径:
1、看电子层数:电子层数越多半径越大:例如Na>Li,Na>Na+,
2、看核电荷数:电子层数相同时,核电荷数越大半径越小(“序大径小”):例O>F,S2->Cl-,
3、看电子数:电子层和核电荷数都相同时,电子数越多半径越大。例如Cl->Cl。
上面方法是否正确呢?其实有许多错误。
1、第二周期元素Li大于第三周期元素Al、Si、P、S、Cl;第二周期元素Be大于第三周期元素P、S、Cl。
2、许多离子的半径比较用上面的方法就是错误的。
二、高考题的思维
下面我们来回答一下:O2-的半径比F-的半径大还是小?
根据我们中学老师的思维:电子层数相同时,核电荷数越大半径越小(“序大径小”),回答大。
而且有高考题为证:
2019年高考全国卷II理综化学第35题:(3)比较离子半径:F−_____O2-(填“大于”等于”或“小于”)。答案是小于。
2008年山东高考理综第11题:下列说法正确的是
A . SiH4比CH4稳定
B .O2-半径比F-的小
C. Na和Cs属于第IA族元素,Cs失电子能力比Na的强
D . P和As属于第VA族元素,H3PO4酸性比H3AsO4的弱
答案选C。
但是查文献得的离子半径数据是:r(O2-)=132 pm,r(F-)=133 pm。这是什么原因呢?
三、我们来充电——原子半径
我们一起来学习一下原子半径相关知识。
原子半径定义为核到最外层电子的平均距离。
根据量子力学,核外电子运动没有固定轨道,没有明确的界限,只有几率密度的分布,现代的科学技术还无法精确测定一个单独原子的半径,只能用实验方法,如x射线衍射法,测定出晶体中相同原子核间距离,或用同核双原子分子键长,被2相除得出。
不同元素原子有不同的存在形式,就是同一元素的原子也可能形成不同化学键的分子和晶体。因而不同元素的原子半径可能表现形式不同,就是同一元素的原子半径也可能有不同形式。
根据测定方法的不同,通常有3种原子半径:
①金属半径:

金属晶体中相邻两金属原子核间距离的一半,称做该元素原子的金属半径,如铜的金属半径 r金=127.8pm。
②共价半径:
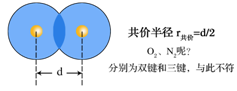
同种元素的两原子以共价键结合时,其共价键键长的一半称做该元素原子的共价半径,符号表示为pm或Å,其数值与几重键结合有关,如碳原子的共价半径 r共,单键时为77pm,双键时为67pm,三键时为60pm。
金属元素原子在一定条件下也可形成共价的双原子分子,金属元素原子也有共价半径,如铜的共价半径 r共为117pm。由于形成共价键时,总会发生原子轨道重叠,通常同一金属元素的金属半径比其单键共价半径要大10%~15%。
同周期元素的单键共价半径的变化规律为从左至右逐渐缩小,可认为是原子核对电子引力增大的缘故。
③范氏半径:
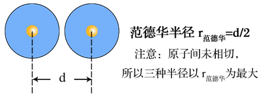
(范德华氏半径的简称)非金属元素和有些金属元素所形成的分子间或稀有气体单原子分子间靠分子间力(范德华力)相互吸引,其不同分子中两个相同原子核间距离的一半,称做该元素原子的范氏半径,如氯原子的范氏半径 r范为181pm。如图所示,表示了氯原子的共价半径和范氏半径。
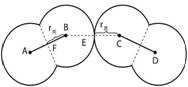
原子半径数据只有相对的、近似的意义,而且同一元素的不同半径,数值不同(r范>r金>r共),而且相差较大。
使用时不要同时用不同半径的数据。
在一般的资料里,金属元素有金属半径和共价半径的数据,非金属元素则有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。
中学课本中给出的原子半径数据除稀有气体元素外,均为共价半径,稀有气体原子半径是范氏半径。所以比较原子半径时一般排除稀有气体元素。
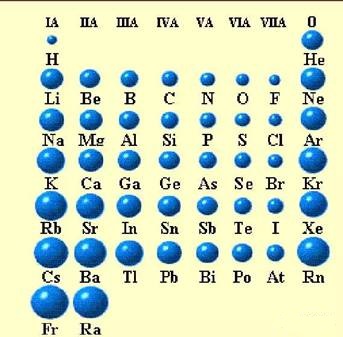
一般来说在同一族里,从上到下,原子半径一般是增大的,主族元素由上到下,半径毫无例外地增大,只是增大的幅度逐渐减小。
但是在副族里,属于第五和第六周期的元素,如Zr与HF、Nb与Ta、Mo与W,它们的原子半径非常接近,这主要是由于镧系收缩的结果。
在短周期(第二和第三周期)里,由左至右原子半径都是逐渐减小的,
长周期元素(第四、第五和第六周期的元素)虽然总的趋势仍然是原子半径缩小,但其中的过渡元素特别是镧系元素减小的趋势要缓和得多。这是由于屏蔽作用,因此从58号到71号元素原子半径减少更加缓慢。
四、我们来充电——离子半径
离子半径是表示离子大小的一个物理量。
现代测试手段还不能直接量取正负离子球体的半径。
一般所说的离子半径是:离子晶体中正负离子的核间距离是正负离子的半径之和。正负离子的核间距为d,则d=r++r-。
数值d可通过晶体的X射线衍射分析实验测得。并以氟离子F-半径=133pm,或氧离子O2-半径=132pm作为标准,然后再推算出其他离子半径。
如实验测得的氟化钠的d=230pm,则Na+的半径是230-133=97pm。
离子半径的大小还要受离子化合物构型的影响。一般以氯化钠构型的半径作为标准,即以配位数为6作标准(在每一个钠离子周围直接连有6个氯离子,反之亦然。将与钠离子或氯离子直接相连的带异电荷的离子数称为配位数)。如离子实际配位数为8,则半径值应增加约3%,若配位数为4,则半径值应下降约5%。
在周期表各族中,离子半径一般随原子序数的递增而增大。同一周期中,阳离子的电荷数越大,它的半径越小,阴离子的电荷数越大,它的半径越大。当原子失去电子变成阳离子时,半径要缩小,如钠原子的半径为137pm,而钠离子半径是97pm。当原子得到电子变成阴离子时半径要增大,例如氯原子的半径是99pm,而氯离子的半径是181pm。
若同一元素能形成几种不同电荷的离子时,高价离子的半径小于低价离子的半径。例如Fe2+离子半径是74pm,Fe3+离子半径是64pm。
负离子的半径较大,约为130~250pm,正离子半径较小,约为10~170pm。
目前仍广泛应用的离子半径主要有4种,其中3种离子半径测算标准对比如表1。
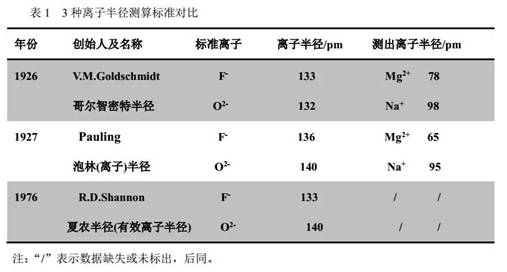
第4种离子半径是由俄国科学家雅茨米尔斯基(Yatsmirskii)提出的,称为热化学半径与泡林半径没有可比性。
从上表可看出,r(O2-)、r(F-)大小所选用标准不同,其相对大小有时恰好相反。因此,建议在命题时,尤其是高考命题,最好规避r(O2-)、r(F-)的大小比较。
根据下面文献中的数据,请比较一下氟离子与钙离子的比较。
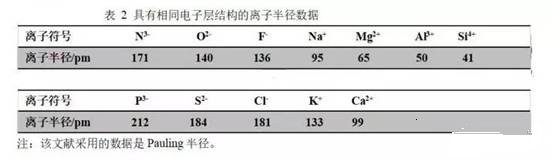
通过此文的学习,是不是发现原子、离子半径比较不是一件简单的事。

- 全部评论(0)
