常见硫酸盐的简介
时间:2022-08-12 15:47 来源:摘抄于因特网 作者:武群 点击:次 所属专题: 硫酸盐
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
石膏的利用与开发
人类对石膏的利用,至少也有上千年了。古代的中医就用石膏作为清热泻火药,主治发烧、烦渴、肺热咳嗽和胃火牙痛。近代医学又用石膏治疗骨折。我们平常吃的豆腐,有些就是用石膏作凝结剂。在化学工业和轻工业中,石膏可用来生产硫酸、硫酸铵(一种化肥)以及作为橡胶、油漆和纸张的填料,学校里用的粉笔大都是用石膏做的,有一种奇妙的透明石膏还可用来制造光学仪器。石膏还可直接用作土壤调节剂,它能降低土壤的碱性和改善土壤的物理性状。在陶瓷工业和机械工业中,石膏可以用来制作模具。用石膏制造的工艺美术品和各种造型、塑像浪漫典雅、栩栩如生。在建材工业中,石膏既是生产水泥的辅助原料缓凝剂,又可直接制造多种建筑材料例如纸面石膏板、纤维石膏板、石膏空心条板、石膏砌块、石膏代木板材等。
石膏的这么多种用途,哪一种是它最大的用途呢?这在发达国家和发展中国家是不一样的。发达国家一般主要直接用石膏来生产各种墙体材料及其它建筑制品,其次是用作水泥的辅料,第三是用作农田凋节剂。而发展中国家包括我国则主要是把石膏用于生产水泥和改良土壤,然后才是用来直接生产建筑制品。这个差异在一个方面反映出发达国家与发展中国家不同的富裕程度。为什么这样说呢?因为用石膏直接生产建筑制品的成本比用水泥、砂、石生产建筑制品要高,当然只有比较富裕的国家才能更多的使用石膏建筑制品。
那么是不是说在石膏的利用与开发方面,我们要完全重复发达国家的发展进程呢?也不完全是这样。随着科学技术的进步以及人类对石膏认识的加深,发展中国家中石膏建筑制品在石膏各种用途中所占的比例,将以较快的速度赶上发达国家的状况。
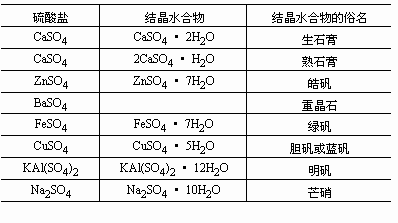
首先,我们知道,天然石膏的主要成分是含有两个结晶水分子的硫酸钙(CaSO4·2H2O),叫做二水石膏,俗称生石膏。要用石膏来制造建筑制品,首先要把二水石膏煅烧成半水石膏(CaSO4·1/2H2O),俗称熟石膏、烧石膏,不同的煅烧条件所得的半水石膏的性能是不一样的。简单加热制得的半水石膏是吸水性较强的β型石膏,又称建筑石膏,制品的抗压强度一般只有7至10兆帕。在高压饱和水蒸汽条件下制得的半水石膏是吸水性较弱的α型石膏,又称高强石膏,制品的抗压强度可达15至40兆帕,大致相当于150号至400号水泥。显然,生产α型石膏的成本较高。而且不论β型还是α型石膏,它们的制品的耐水性都较差。它们遇水后,只需几分钟就可还原成二水石膏,这就是热石膏的水化凝结过程。经晾晒脱除了多余水分后,石膏就成了定型且有一定强度的制品。但是如果石膏制品重新遇到潮湿环境,二水石膏又能逐步被多余的水溶解,使制品的强度降低。为了攻克石膏制品耐水性差的难题,国内外科学家进行了上百年的研究和开发,取得了越来越大的进展,现代已经有了多种方法可以改善石膏制品的耐水性。例如,有些科学家在低成本的β石膏中加入某些改性剂,可使其制品的耐水性能提高数倍,在水中浸泡几十天也不溶解散烂。还有些科学家研制成新型防水涂料,涂在石膏制品表面,不仅滴水不渗,而且亮似瓷器,既可扩大石膏制品的使用范围,又可增加它的美观程度和装饰功能。这些科技方面的进步对于发展中国家加速提高石膏建筑制品的比例是十分有利的。
其次,人类对于健康和环保的重视程度越来越高,结果发现使用石膏建筑制品比使用水泥和粘土制品更有利于人类健康和环境保护。石膏制品的密实度低于水泥制品,内部孔隙较多,呼吸功能较强,能在较大范围内自动调节室内湿度。其导热系数也小于水泥制品,有助于冬暖夏凉和减少对空调、暖气的依赖。其隔音性能也胜过水泥制品,石膏可用来制造优质吸音板材。居住和工作在石膏做墙壁和屋顶的房间里,人体各方面的感觉都比较舒适。从能源消耗而言,生产1T熟石膏粉的能源消耗远低于生产1T水泥的消耗。从资源消耗而言,生产水泥还是需要消耗一定数量的粘土,而生产热石膏无需消耗粘土,用石膏比用水泥更有益于保护地球土壤和农田,近年开发成功的石膏代木建材,还有益于保护森林资源防止地表沙漠化。从环境污染而言,水泥厂的烟尘对空气的污染大大超过石膏厂的污染。为了本国人民的身体健康和国家民族的可持续发展,发展中国家必将尽可能多的使用石膏建筑制品。
极为幸运和可喜的是我国的石膏储量居世界首位,全国几乎各省、市、自治区都有石膏矿。无比巨大的宝藏正等待着我们去进一步开采、利用和开发。尽快提高我国石膏直接用作建筑制品的比例,将在一个方面反映我国四化建设和提高人民生活水平的迅速进步。
硫酸亚铁 (FeSO4·7H2O)俗称绿矾或黑矾。浅绿色单斜晶体。密度1.898g/cm3,熔点64℃,90℃可失去结晶水,沸点300℃,无水硫酸亚铁为白色固体。易溶于水,在水中有微弱水解使溶液显酸性。在空气中可逐渐风化失去一部分水,并且表面易氧化为黄褐色的碱式硫酸铁Fe(OH)SO4。绿矾可失去结晶水得白色FeSO4,强热可分解成Fe2O3和三氧化硫、二氧化硫,易跟碱金属或铵的硫酸盐形成复盐。如硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O,也叫摩尔盐,是分析化学中常用的还原剂。还可用来制蓝黑墨水,主要是硫酸亚铁跟鞣酸反应生成鞣酸亚铁,在空气中又易被氧化为黑色的鞣酸铁。还可用于染色和木材防腐,农业上可用作杀虫剂。也可用来浸泡种子防治麦粒的黑穗病和条纹病。医疗上可作补血剂,工业上硫酸亚铁是由冶金副产品得到。
芒硝 化学组成为Na2SO4·10H2O、晶体属单斜晶系的含水硫酸盐矿物。明代李时珍(1518~1593)的《本草纲目》中记载,芒硝“见水即消,又能消化诸物,故谓之消。”并按形态不同而分别命名为“朴消”、“芒消”和“牙消”。英文名则来自拉丁文Mirabile(奇怪),是德国化学家J.R.格劳贝尔(Glauber)在用硫酸和食盐人工合成出本化合物时所表示的惊奇,故名。工业矿物原料上所指芒硝,常包含无水芒硝和钙芒硝,用以制取硫酸铵、硫酸钠、硫酸及硫化钠等化工原料。其中用于制造洗衣粉的芒硝占总用量的65~70%。芒硝晶体呈短柱状或针状,通常成致密块状、纤维状集合体。无色或白色,玻璃光泽。具完全的板面解理。摩斯硬度1.5~2,比重仅1.48。味清凉略苦咸,极易潮解,在干燥的空气中逐渐失去水分而转变为白色粉末状的无水芒硝。产于干涸的盐湖中,与石盐、石膏等共生。现代芒硝矿床产于内陆湖泊和海滨半封闭的海湾潟湖里,在干燥炎热的条件下,温度在33℃以上蒸发时,形成无水芒硝;在33℃以下或秋冬气温下降时,可形成芒硝。世界上芒硝湖的分布以中国和前苏联较多,中国现代芒硝湖主要分布在西藏、内蒙古、黑龙江、山西、吉林等省、区。古代芒硝矿床产在陆相湖泊沉积岩系里,一般是在红色砂页岩系中呈透镜体状产出。中国湖北省的储量居全国之首。
硫酸铵 [(NH4)2SO4]简称硫铵,俗称肥田粉。为无色斜方晶体。密度1.769g/cm3(50℃)。在敞口容器中加热至100℃即开始分解成硫酸氢铵NH4HSO4和氨,其熔点为146.9℃。易溶于水,由于水解,溶液呈酸性:
NH4++H2O
硫酸铵主要用作化肥,含氮20~21%是一种速效氮肥,广泛用于一般农作物,对于酸性土壤应与石灰配合(不能混合)使用,即施用硫铵一段时期后,再施用适量石灰,达到中和酸度的目的。还用作化学试剂、焊药和织物防火剂。工业上主要用氨跟硫酸直接作用,或将氨和二氧化碳通入石膏粉的悬浮液中,都可制得硫酸铵:2NH3+H2SO4==(NH4)2SO4 CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓
硫酸锌 俗称皓矾,无色或白色晶体,受热时未到熔化即于600℃分解为ZnO与SO3,溶于水,常见的皓矾为七水合物ZnSO4·7H2O,无色晶体,易溶于水,280℃失水成无水物。水溶液呈弱酸性(Zn2+水解)。与Na2S溶液产生白色沉淀ZnS;与少量NaOH溶液生成白色胶状Zn(OH)2沉淀,NaOH过量则溶为Na2ZnO2,是Zn(OH)2两性的体现之一。若用新配制的BaS溶液与ZnsO4溶液以相同物质的量浓度和相等体积反应,则生成两种白色沉淀:ZnsO4+BaS==BaSO4↓+ZnS↓,物质的量比为1∶1,其遮盖力很强为白色颜料锌钡白(立德粉),皓矾还用做媒染剂、收敛剂、补锌药剂、木材防腐剂等。
波尔多液 主要成分是碱式硫酸铜Cu(OH)2·CuSO4。呈不透明、松绿色的悬浊液。有杀菌作用。农业上用于防治棉花叶斑病和烂铃、马铃薯晚疫病、稻热病、烟草炭疽病、葡萄霜霉病、柑桔疮痂病,以及白菜、黄瓜的霜霉病等。要在发病以前喷洒使用效果大。可由硫酸铜、生石灰和水按比例1∶1∶100配制。

- 全部评论(0)
