臭氧分子中的键有极性吗?
时间:2016-01-21 12:36 来源: 作者:宋洲 点击:次 所属专题: 臭氧 键的极性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
当前,就臭氧分子中的键是否有极性问题在中学化学教师中有两种截然不同的看法。一种认为,臭氧分子中的键无极性。理由是化学键的极性是由两个成键原子吸引电子的能力不同或电负性差值决定的,差值为零,共用电子对不偏向任何一个原子,为非极性键。另一种则认为,臭氧分子中的键有极性。理由是分子若有极性,则分子内必存在极性键。那么,臭氧分子中的键究竟有没有极性?若有极性又如何理解呢?本文就这个问题谈点浅见。
一、键的极性与分子的极性
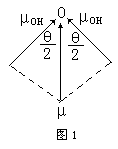
从本质上讲,键的极性是由于成键原子电荷分布不对称,正负电荷重心不重合而引起的,键的极性大小可用键矩来衡量。键矩为零,则键无极性,键矩不为零,则键有极性。键的极性大小还可由电负性差值来判断,成键原子电负性差值为零,则键无极性,差值不为零,则键有极性,差值越大则键的极性越大。分子的极作是由于整个分子中电荷分布不对称、不均匀,正负电荷重心不重合而引起的。分子的极性大小可由分子的偶极矩来描述,极性分子都有偶极矩,极性分子的偶极矩等于正负电荷重心间的距离与正电重心(或负电重心)上电量-Q(或-Q)的乘积。偶极矩是个矢量,其方向是从正电重心(正极)指向负电重心(负极),单位一般采用“德拜”(D)。键的极性与分子的极性关系是:键的极性是分子极性的基础,分子的极性则是键的极性之综合结果(矢量加和)。具体来说,它们有如下几种关系:1.分子中的键若无极性,则分子无极性;2.键若有极性,分子不一定有极性;3.分子若有极性,则分子内必存在极性键;4.分子若无极性,其键不一定都无极性。分子的极性是由键的极性和分子的空间构型或分子中键的空间排列决定的。多原子分子的偶极矩等于分子中所有键矩的矢量和。例如:H2O分子的偶极矩(μ)为1.85D,键角(α)为105°,则O-H键的键矩(μOH)与H2O分子的偶极矩μ的关系如下(图1):
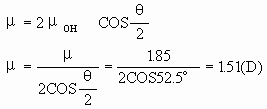
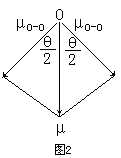
同理,可根据实验测得的臭氧分子的偶极矩(μ=0.53D)和分子构型(角型,键角θ=116.8°),求出O3分子中的键矩(图2):
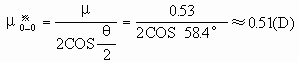
![]()
为什么同种原子构成的键会显极性呢?
二、现代价键理论的回答
现代价键理论认为,O3分子中的中心氧原子采取sp2杂化形成三个sp2杂化轨道,中心氧原子利用它的两个未成对电子分别与其它两个配位氧原子中的一个未成对电子结合,占据2个杂化轨道,形成两个σ键,第三个杂化轨道由孤对电子占据。(如图3、图4)
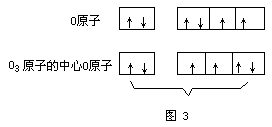
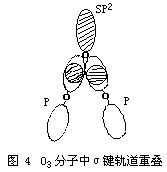
实验测得,O3是反磁性的。O3分子中的键角为116.8°,键长为127.8PM。该键长正好介于氧原子间单键键长148PM与双键键长112PM之间,因此,O3分子中氧原子间的键介于单键与双键之间的重叠,也就
![]()
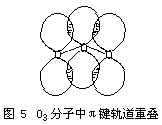
![]()

原子平均享用,所以中心氧原子供给的2个电子部分为两边的配位氧原子所有,即发生了离域,致使中心氧原子显得正一些,两边氧原子显得负一些。所以O3分子中的键矩不等于零,键有极性。而O3分子结构又不对称,所以O3分子有偶极矩而显极性。
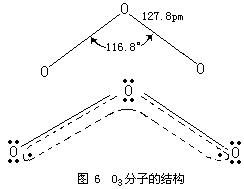
综上所述,O3分子是包含有极性键的极性分子。同时应当着重指出,根据成键原子电负性差值来判断键的极性并没有错。只是应当注意:一种原子的电负性值不是一成不变的,原子化合价不同,成键的原子轨道不同,电负性值也不同。O3分子中的中心氧原子与配位氧原子的价态实际不同,电负性值不等,即O3分子中配位氧原子与中心氧原子的电负性差值不为零,因此,O3分子中的键有极性。这一点与前面的论述并不矛盾。

- 全部评论(0)
