原子结构与性质疑难剖析
时间:2022-08-06 09:56 来源:未知 作者:化学自习室 点击:次 所属专题: 原子结构03与性质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、原子结构与核外排布
1.核外电子共有几个能层?
能层电子层,根据离原子核远近的不同,由里向外可分为第一、二、三、四、五、六、七……能层,分别用符号K、L、M、N、O、P、Q……来表示。
2.每个能层都是从s能级开始,一直到f能级结束吗?
在任一能层中,能级个数=能层序数,即K层只有s能级,L层有s和p两个能级,M层有s、p和d三个能级。
3.如何比较不同能层中同一能级的能量?
不同能层中的同一能级,能层序数越大,能量越高。
4.同一能层中,各能级之间的能量大小有怎样的关系?
同一能层中,各能级之间的能量大小关系是s<p<d<f……
5.1s、2s、3d分别表示什么意义?
能层序号写在s、p、d、f等能级符号前,共同表示能级,如同第几层楼的第几级楼梯一样,如3d、4s等,能层就是电子层,能级是电子层中的电子亚层,在含有多个电子的原子里,由于电子的能量是不相同的,因此,它们运动的区域也不同,通常能量低的电子在离核近的区域运动,而能量高的电子在离核远的区域运动,影响各能级能量的最大因素是能层:同一能层中,各能级之间的能量大小关系是s<p<d<f;不同能层中同一能级,能层序数越大,能量越高,如:1s<2s<3s,2p<3p<4p;能层数小于3时,能层越高,能量越高。1s表示第一能层中的s能级;2s表示第二能层中的s能级;3d表示第三能层中的d能级。
6.钠原子第三能层只有3s能级填充电子,是否可以说钠原子第三能层只有3s能级?钠原子有3个能层填充电子,是否可以说钠原子只有3个能层?
不可以,钠原子第三能层有3s、3p、3d能级,只有3s能级填充电子,3p、3d能级没有电子;不可以,钠原子具有若干能层,但只有K、L、M三个能层填充电子,其他能层没有电子。
7.原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)之间存在什么关系?
每一个能层最多可容纳的电子数为2n2。
8.不同能层相同类型的能级中所容纳的电子数有什么规律?
不同能层相同类型的能级中所容纳的电子数是相等的,s、p、d、f……能级容纳的电子数依次为1、3、5、7……的2倍,即2、6、10、14……。
9.第5能层所容纳的最多电子数是多少?
依据每一个能层中最多可容纳的电子数为2n2,当n=5时,2n2=50;或第五能层中有五个能级,即5s、5p、5d、5f、5g,各能级可容纳的最多电子数分别是2、6、10、14、18,所以第五能层所容纳的最多电子数为50。
10.如何理解能层和能级的数量关系?
能层序数等于能层中的能级数; s、p、d、f……能级所包含的轨道数分别是1、3、5、7……,根据泡利原理可知每个轨道最多容纳两个自旋状态相反的电子,所以每个能级最多容纳的电子数为其轨道数的2倍;能层最多容纳的电子数为2n2(n代表能层序数),如在第二能层有s、p两个能级,s能级容纳的电子数为1×2=2,p能级容纳的电子数最多为3×2=6,所以第二能层最多容纳的电子数为2+6=2×22,所以每一能层最多容纳的电子数为2n2。
11.能层数越大的能级,其能量一定越高吗?
不一定,还存在一些不同能层能级的交错现象。例如,E(3d)>E(4s)、E(4f)>E(5p)、E(4f)>E(6s)等。
12.为什么K原子的原子结构示意图不是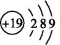 ,而是
,而是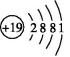 呢?
呢?
由于出现能级交错现象,K原子排满第一层和第二层后,在排第三层时,先排满3s能级、3p能级,最后一个电子进入4s能级而不是3d能级,所以它的原子结构示意图为 。
。
14.从哪个能级开始出现能级交错?
3d能级与4s能级。
15.所有原子和核外电子排布都遵循构造原理吗?
不是,构造原理是根据光谱事实总结的一般规律,适用于绝大多数原子。
16.根据构造原理中的排布顺序,不同能层不同能级的排布遵循什么规律?
构造原理中的排布顺序,其实质是各能级的能量高低顺序,有如下关系:ns<(n-2)f<(n-1)d<np(n表示能层序数)。
17.为什么原子最外层、次外层最多容纳的电子数分别为8、18?
最外层由ns、np组成,电子数不大于2+6=8;次外层由(n-1)s(n-1)p(n-1)d组成,电子数不大于2+6+10=18。
19.根据构造原理,Fe原子的电子排布式应怎样表示?
根据构造原理,Fe原子的电子排布式应为1s22s22p63s23p63d64s2。
20.21号元素钪的核外电子填充顺序和其电子排布式的书写顺序是否一致?
不一致。电子进入能级的顺序是优先进入能量低的能级,然后进入能量高的能级。由于4s和3d轨道有能级交错现象,所以21号元素钪的核外电子填充顺序为1s22s22p63s23p64s23d1。电子排布式的书写是按照能层序数的高低顺序排列的,所以钪的电子排布式为1s22s22p63s23p63d14s2。
21.元素周期表中钠的电子排布式可写成[Ne]3s1,方括号里的符号是什么意义?同理写出8号、14号、26号元素简化的电子排布式。
方括号里符号的意义是稀有气体元素原子的结构,表示该元素前一周期的稀有气体原子的电子排布结构;O:[He]2s12p4;Si:[Ne]3s23p2;Fe:[Ar]3d64s2。
22. 书写电子排布式应注意哪些问题?
(1)电子的填充顺序:先根据构造原理上的能级顺序依次写出每个能级符号,再依据每个能级最多容纳的电子数,填满一个能级再填下一个新能级;
(2)在书写电子排布式时,能级的顺序要按照能层序数由小到大的顺序排布。即当出现d轨道时,电子按ns、(n-1)d、np的顺序填充,但在书写电子排布式时,再把(n-1)d写在ns的前面,如Mn:1s22s22p63s23p63d54s2,而不能写成1s22s22p63s23p64s23d5;
(3)为了方便,常把稀有气体符号外加方括号来表示电子排布式。例如,K:1s22s22p63s23p64s1,其中1s22s22p63s23p6看成[Ar]“原子实”,4s1叫作价电子,故K的电子排布式可表示为[Ar]4s1。
23.电子在原子轨道外是否有可能出现?
原子轨道只概括电子在原子核外空间出现概率90%的空间,因此电子在原子轨道外有可能出现。
24.在电子云轮廓图中小黑点的意义是什么?
一个小黑点表示电子在该处出现一次,小黑点密的地方表示电子在该处空间单位体积内出现的概率大,小黑点疏的地方,表示电子在该处空间单位体积内出现的概率小。
25.能层与能级(原子轨道类型)及原子轨道数目有何关系?
第n能层上有n个能级,n2个原子轨道。例如,第3能层就有3个能级(3s、3p、3d),包含9个原子轨道,不同能级中的电子云可能有不同的伸展方向,即可能有不同的原子轨道。
26.不同能层的同种能级的原子轨道形状是否完全相同呢?
不同能层同种能级的原子轨道形状相似,但不完全相同。只是原子轨道的半径不同,能级序数n越大,电子的能量越大,原子轨道的半径越大。例如1s、2s、3s轨道均为球形,原子轨道半径:r(1s)<r(2s)<r(3s)。
27.如何理解原子轨道?
要准确描述一个电子的运动状态需要用到能层、能级、电子云伸展方向(轨道的伸展方向)、自旋方向等概念。电子在核外运动没有确定的轨道,也不能预测某时刻的位置,人们只能用统计的方法形象地描述电子在核外空间出现概率的大小。ns能级、np能级、nd能级、nf能级……具有的原子轨道数分别为1、3、5、7……且s(或p、d……)能级的原子轨道半径随能层数的增加而变大。不同原子的电子即使能级相同,能量也不相同,所以不同的元素具有不同的原子光谱。
28.为什么原子的核外电子排布要遵循能量最低原理呢?
能量最低原理是自然界普遍遵循的规律。能量越低,物质越稳定,物质都有从高能量状态转化到低能量状态的趋势。
29.泡利不相容原理解决了电子排布的哪些问题?
电子排布时每个轨道填入电子的最多数目。
30.洪特规则解决了电子排布的哪些问题?
洪特规则解决了多个电子如何填入能量相同的轨道。
31.为什么基态Cr原子的外围电子排布式为3d54s1而不是3d44s2?
能量相同的原子轨道在全充满、半充满、全空时,体系能量较低。
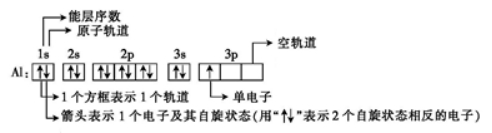
32.电子排布图中各符号和数字的意义是什么?
以Al原子为例理解电子排布图中各符号和数字的意义。
33.1—36号元素核外电子排布有何特殊性?
最外层只有1个未成对电子的元素有ⅠA族(ns1:H、Li、Na、K)、ⅢA族(ns2np1:B、Al、Ga),ⅦA族(ns2np5:F、Cl、Br),过渡元素Cr(3d54s1)、Cu(3d104s1);最外层有2个未成对电子的元素有ⅣA族(ns2np2:C、Si、Ge),ⅥA族(ns2np4:O、S、Se);最外层有3个未成对电子的元素有ⅤA族(ns2np3:N、P、As);核外电子排布中,未成对电子数最多的元素是Cr(3d54s1,共有6个未成对电子)。
二、原子结构与元素的性质剖疑
1.元素原子的价电子就是最外层电子吗?
不是,主族元素的最外层电子是价电子,过渡元素的价电子还可能包括次外层的d电子或倒数第三层的f电子。
2.除氦外,0族外围电子排布有何特点?
除氦外,0族最外层均有8个电子,电子排布式为ns2np6。
3.最外层电子排布式为ns1或ns2的元素是否一定为金属元素?
不一定。如H的最外层电子排布式为1s1,He的最外层电子排布式为1s2,但它们均是非金属元素。
4.族与原子的价电子排布有什么关系?
(1)主族:周期表中共有7个主族,ⅠA~ⅦA,凡内层轨道全充满,最后1个电子填入ns或np轨道上的,都是主族元素,价层电子的总数等于族数(用罗马数字表示),即等于ns、np两个轨道上电子数目的总和;
(2)副族元素:周期表中共有ⅠB~ⅦB七个副族。凡最后一个电子填入(n-1)d轨道上的都属于副族;ⅢB~ⅦB族元素,价电子总数等于(n-1)d、ns两个轨道电子数目的总和,也等于其族数。ⅠB、ⅡB族由于其(n-1)d轨道已经填满,所以最外层ns轨道上电子数等于其族数;
(3)Ⅷ族:它处在周期表的中间,共有3个纵列。第四周期Ⅷ族最后1个电子填在3d轨道上,与副族元素同属于过渡元素,价电子总数是8~10。
5.s区、p区、d区元素最后填入的电子的能级符号分别是什么?
s区、p区、d区元素最后填入的电子的能级符号分别是ns、np、nd。
6.元素周期表划分区的依据是什么?
元素周期表划分区的依据是原子的价层电子排布。
7.区的名称与电子的能级符号之间有什么关系?
区的名称来自于按构造原理最终填入电子的能级的符号(除ds区外)。
8.元素周期表中族和分区的什么关系?
(1)主族:s区和p区。(ns+np)的电子数=族序数。(2)0族:p区。(ns+np)的电子数=8(或2)。(3)副族: d区中[(n-1)d+ns]的电子数=族序数(第Ⅷ族部分元素除外);当8≤[(n-1)d+ns]的电子数≤10时,则为第Ⅷ族元素;ds区中(n-1)d全充满,ns的电子数=族序数。
9.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现了吗?
现代元素周期表是按现在已知的112种元素编制的,第七周期仍未排满,随着科学技术的发展,一些新的元素将不断地被发现,现代元素周期表在不断完善和发展中。
10.元素周期表中的同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种变化趋势?周期表中的同主族元素从上到下,原子半径的变化趋势又如何?应如何理解这种变化趋势?
同周期主族元素从左到右,原子半径逐渐减小,其主要原因是由于同周期主族元素的电子层数相同,核电荷数的增加使原子核对核外电子的引力增加而引起的原子半径减小趋势大于增加电子后电子间斥力引起原子半径增大的趋势。同主族元素从上到下,原子半径逐渐增大,其原因是电子层增加,电子间的斥力引起原子半径增大。
11.原子能层数多的元素的原子半径是否一定大于原子能层数少的元素的原子半径?
不一定,原子半径的大小由核电荷数与原子的能层数两个因素综合决定,如碱金属元素的原子半径比它下一周期卤素原子的半径大。
12.已知A的原子半径大于B的原子半径,那么A的离子半径一定大于B的离子半径吗?
原子半径与离子半径大小不同,有时可能出现相反的结果。如原子半径:Na>F,离子半径:Na+<F-。
13.当能层数和核电荷数均相同时,微粒半径如何比较?
当能层数和核电荷数均相同时,核外电子数越多,半径越大。
14.如何比较微粒半径的大小?
同周期元素的原子半径随核电荷数的增大而减小(稀有气体元素除外),如:Na>Mg>Al>Si>P>S>Cl;同主族元素的原子半径随电子层数的增多而增大,如:Li<Na<K<Rb<Cs;同种元素原子,其阳离子半径小于原子半径,阴离子半径大于原子半径;同主族元素的离子,其半径随核电荷数的增大而增大。如:F-<Cl-<Br-<I-;电子层结构相同的离子,其半径随核电荷数的增大而减小;同一元素不同价态的微粒半径,价态越高,离子半径越小。
15.同周期、同主族元素第一电离能的变化有什么规律?
同一种元素的逐级电离能大小关系:I1<I2<I3<I4<I5……即一个原子的逐级电离能是逐渐增大的,这是因为随着电子的逐个失去,阳离子所带的正电荷数越来越大,要再失去一个电子需克服的电性引力也越来越大,消耗的能量也越来越多。一般来说,同周期元素从左到右,第一电离能逐渐增大;同主族元素从上到下,第一电离能逐渐减小。
16.第ⅡA族元素和第ⅤA族元素第一电离能的反常现象如何解释?
一般地,同周期元素从左到右,第一电离能逐渐增大,但ⅡA族元素第一电离能大于同周期第ⅢA族元素;第ⅤA族元素第一电离能大于同周期第ⅥA族元素。因为第ⅡA族元素的外围p轨道是全空结构,第ⅤA族元素的外围p轨道是半充满结构,它们都比较稳定。所以第一电离能Be比B大,N比O大,P比S大,Mg比Al大。
17.Mg的第一电离能比Al的大,所以Al比Mg易失去电子,但我们以前学习的金属活动性顺序中,Mg比Al易失电子,这是什么原因呢?
金属的活动性按照K、Ca、Na、Mg、Al……顺序逐渐减弱,该顺序表示自左到右在水溶液中金属原子失去电子越来越困难。 电离能表示金属原子在气态时失去电子成为气态正离子的能力,它是金属原子在气态时活泼性的尺度。
18.根据钠、镁、铝电离能的变化分析,为什么原子的逐级电离能越来越大? 为什么钠元素的常见价态为+1价,镁元素的为+2价,铝元素的为+3价?
(1)因为首先失去的电子是能量最高的电子,故第一电离能较小,以后再失去电子都是能级较低的电子,所需要的能量多;同时失去电子后,阳离子所带的正电荷对电子的引力更强,从而使电离能越来越大。
(2)原子失去电子形成稳定结构后,不容易再失去电子,因而再失去电子时的电离能就特别大,电离能的突跃可说明核外电子是分能层排布的。钠原子的第一电离能较低,而第二电离能突跃式变高,也就是说,钠的第一电离能远远小于它的第二电离能。这说明钠原子很容易失去一个电子成为+1价的阳离子,从而形成稀有气体元素原子的稳定状态,此时原子核对外层电子的有效吸引作用变得更强,不再失去第2个电子。因此,钠元素的常见化合价为+1价,同理可分析镁和铝。
19.元素周期表中电负性最大的元素和电负性最小的元素是什么?
电负性最大的元素为氟,电负性最小的元素为铯。
20.如何理解同周期元素电负性的递变规律?
同周期元素从左到右原子半径逐渐减小,核电荷数逐渐增多,原子核吸引电子的能力逐渐增强,电负性逐渐增大。
21. “根据定义,电负性只能判断非金属性的强弱,电离能只能判断金属性的强弱。”这种说法正确吗?
这种说法是错误的。电负性和电离能都可用于判断元素的金属性和非金属性的强弱。电负性越大,元素原子吸引电子的能力越大,非金属性越强;电负性越小,元素原子吸引电子的能力越小,金属性越强。一般来说,金属元素的电负性在1.8以下,非金属元素的电负性在1.8以上。第一电离能越大,元素的原子越难失电子,非金属性越强(稀有气体除外);第一电离能越小,元素的原子越易失电子,金属性越强。
22.电负性有哪些应用?
(1)判断元素的金属性和非金属性及其强弱:金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于金属、非金属分界线两侧的元素的电负性则在1.8左右,它们既有金属性,又有非金属性;金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼;电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值;电负性数值较大的元素在化合物中吸引电子能力较强,元素的化合价为负值。
(2)判断化学键的类型:一般地,如果两个成键元素原子间的电负性差值大于1.7,它们通常形成离子键,相应化合物为离子化合物;如果两个成键元素原子间的电负性差值小于1.7,它们通常形成共价键,相应化合物为共价化合物,且电负性数值差值越大,共价键的极性越强;
(3)判断化合物中的元素化合价的正负:在化合物中,电负性数值较小的元素吸引键合电子的能力较弱,元素的化合价为正价,电负性数值较大的元素吸引键合电子的能力较强,元素的化合价为负值。例如在NaH中,Na的电负性为0.9,H的电负性为2.1,钠的电负性小于氢的电负性,所以Na显正价,H显负价。

- 全部评论(0)
