什么是原子半径?
时间:2018-08-08 15:22 来源:未知 作者:吴星 点击: 次 所属专题: 半径分类
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
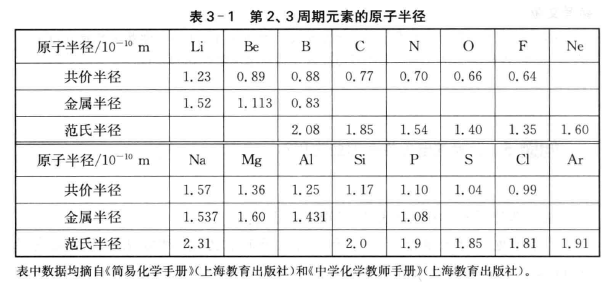
我们知道,原子核的周围是电子云,但原子核外的电子云并不是在离核某一特定距离就完全消失得干干净净,而是逐渐地向外蔓延,只是到离核相当远 处趋向于零,它们是没有确定的边界的。我们通常讲的原子半径是指形成共价键或金属键时,原子间接触所显示的半径。它是通过晶体分析,根据两个相 邻原子的平均核间距离测定的。由于核外电子并没有严格固定的运动轨道, 电子云也没有明确的边界,实际上无法精确地测量原子核至最外层电子的平均距离,因此有关原子半径的数据只有相对的近似意义。原子半径又可分为 共价半径、范德华半径和金属半径。
共价半径如果两种元素的两个原子以共价单键连接时,它们核间距离的一半称为原子的共价半径(如图3-5)。在大多数情况下,不同分子或晶体以相同键型相连接的两个原子A和B的平衡距离近似相等。如甲醇、乙醇、甲 醚等化合物中C一O单键键长是一致的,这种性质称为键长的相对稳定性。此 外,同种键型的键长还具有加和性,由此可推求出不同元素形成共价化合物的 键长。
范德华半径分子晶体中两个相同种类的原子,不是以化学键相结合,而 是以分子间作用力(范德华力)相互作用使其最接近时,两个原子核间距的一 半就是范德华半径(如图3-5)。例如稀有气体在低温下形成的分子晶体中, 原子间没有化学键而只有范德华力,因此稀有气体的原子半径不是共价半径, 而是范德华半径。
金属半径如果把金属晶体看成是由等径球状的金属原子堆积而成的, 相邻两个原子彼此是互相接触的,则它们核间距的一半,就是该原子的金属半 径(如图3-5)。用X射线衍射法测得金属晶体的晶胞参数,结合其点阵型式 就容易计算紧邻金属原子间的距离,其数值的一半即为金属的原子半径。
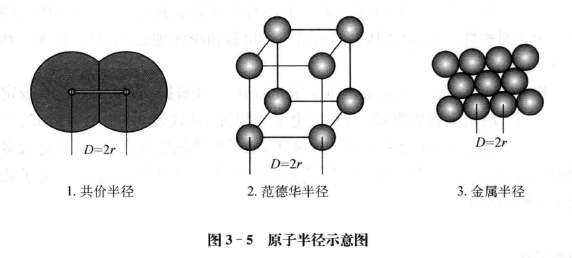
原子半径被认为是最外层电子到核的平均距离,因而影响半径的因素是很多的,概括起来有以下几方面:
•核外电子层的数目。电子层数越多,半径越大。
•核电荷数。核电荷数越大,对核外电子吸引越强,最外层电子至核的平均距离就越小,半径就越小。
•核外电子间斥力。电子间斥力越大,电子间排斥越厉害,最外层电子就可被排斥而离核更远,半径就越大。
•内层电子的屏蔽作用。内层电子对最外层电子屏蔽越大,有效核电荷 数越小,核对最外层电子的吸引力就越小,半径就越大。
在元素周期表中,元素的原子半径有下列变化规律:
•同一周期的主族元素,从左到右,有效核电荷数显著增加,电子层并不增加,核对外层电子的引力增强,使得外层电子向里收缩,导致原子半径明显减小。
•同一族的主族元素,从上到下,有效核电荷数增加不多,由于电子层数 增加,使得原子半径增加显著。
•同一周期的过渡元素,从左到右,有效核电荷数增加不多,原子半径减小比较慢,不如主族那么显著。但当次外层的d轨道全部充满形成18 电子构型时,原子半径忽然增大。这是由于(n-1)d轨道全部充满后对外层电子屏蔽作用较大,使原子核对电子的引力显著减弱。
•对于镧系元素,随着原子序数的递增,镧系元素原子核对外层电子的有 效核电荷数略有增加,使镧系元素原子半径略有减小。整个镧系元素 随原子序数递增原子半径缩小的现象称为镧系收缩。

- 全部评论(0)
