教材分析(必修一):物质分类及转化
时间:2023-08-08 11:38 来源:未知 作者:张德金 点击:次 所属专题: 物质分类 物质转化
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、物质的分类
1、分类
(1)定义:研究对象的共同点和不同点,将它们区分为不同种类和层次的科学方法。
具有相同点的对象归为同一类,具有不同点的对象区分为不同类。
这是处理问题的一种通用科学方法,它能使认识大量事物的速度加快。
比如,将菠菜、香蕉、芹菜、牛肉、苹果、猪肉分为三类:

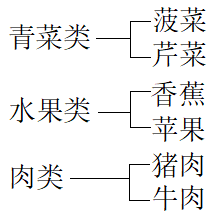
吃过苹果的,大致就能知道香蕉的一些特点:香甜的,可以生吃。
做过猪肉的,大致就能知道牛肉怎么做:炖、炒、涮、煎、烤、带面油炸、做成丸子……
(2)分类时要按照一定的标准,通过分类结果,弄清分类的标准很重要。
比如,将班级中的同学分类:
以身高为标准可以分为>1.8米的、1.8-1.7米的、<1.7米的。
以体重为标准可以分为>75公斤的、75-50公斤的、<50公斤的。
以性别为标准可以分为男生、女生。
注意,容易出现的错误是分类时标准不统一。如,将班级中的学生分别男生、女生、1.8米以上的。
(3)两种常见的分类方法
①树状分类法:
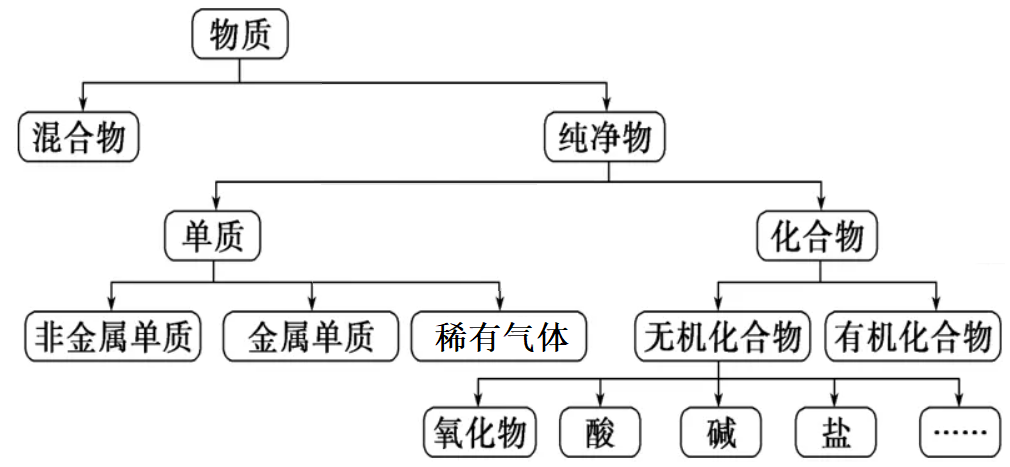
分类点的标准比较单一,分类结果像一棵大树(或倒立的大树)。
缺点是定位到准确对象时,分类次数较多,速率慢。
②交叉分类法:
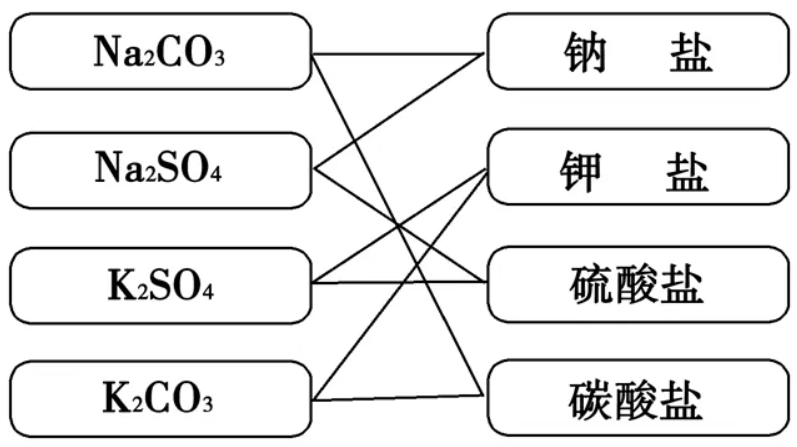
在同一分类层面上的标准有几个,分类结果像一张网。
优点是定位到准确对象时,分类次数较少,速度快。
在用百度搜索“牛顿”时,排在第一位的肯定是英国科学家艾萨克·牛顿。后台在搜索时,不是只搜索了“牛顿”这一个关键词,而是加入了内容搜索频率、你的16岁年龄、你经常搜索的内容的属性等很多标准,所以在浩如烟海的信息中,呈现给你的正是你想要的。

2、关于化学的一些分类
(1)对纯净物用元素组成进行分类
①同种元素组成的,叫单质。
有的单质有多种形态,它们的性质并不完全相同,它们相互之间称为同素异形体。如碳元素组成的金刚石、石墨、C60等,氧元素组成的氧气、臭氧等。

单质根据其性质又分为金属单质、非金属单质、稀有气体。
②多种元素组成的,叫化合物。
无机化合物按组成又分为氧化物、酸、碱、盐等。
A、氧化物:由氧和另一种元素组成的化合物,其中氧的价态为-2价。按性质又分为
a、酸性氧化物,如CO2、SO3、SO2、P2O5、SiO2等。
b、碱性氧化物,如CaO、Na2O、MgO、Fe2O3、CuO等。

c、两性氧化物,如Al2O3等。
d、复杂氧化物,如Fe3O4等。
e、不成盐氧化物,如CO、NO等。
B、酸。按酸性强弱又分为
a、强酸,如盐酸HCl、硫酸H2SO4、硝酸HNO3、氢溴酸HBr、氢碘酸HI、高氯酸HClO4等。
b、比碳酸强的弱酸,如醋酸CH3COOH、亚硫酸H2SO3、磷酸H3PO4等。
c、弱酸碳酸H2CO3。
d、比碳酸弱的弱酸,如硅酸H2SiO3、次氯酸HClO等。
C、碱。按碱性强弱又分为
a、强碱,如KOH、NaOH、Ba(OH)2、Ca(OH)2等。
b、较强的可溶性弱碱一水合氨NH3·H2O。
c、较弱的难溶性弱碱,如Mg(OH)2、氢氧化铁Fe(OH)3、氢氧化亚铁Fe(OH)2、Cu(OH)2等。

D、盐。按组成又分为
a、强酸强碱盐,如NaCl、NaBr、K2SO4、KI、Ca(NO3)2、KClO4等。
b、强酸弱碱盐,如MgCl2、NH4NO3、CuSO4、FeBr2等。
c、弱酸强碱盐,如CH3COONa、K2CO3、Ca3(PO4)2等。
d、弱酸弱碱盐,如CH3COONH4、NH4HCO3等。
(2)将化学物质分为金属单质、非金属单质、氧化物、酸、碱、盐的另一个意义:
在以后学习某一种物质的化学性质时,会将这种物质与上面不同类别的物质进行反应。而选取不同物质的角度,采用的就是上面的分类。
例如,在思考Mg的化学性质时,可以尝试与非金属单质O2或Cl2、氧化物H2O或CO2、酸H2SO4溶液、盐CuSO4溶液来分析Mg的化学性质。
二、分散系及分类
对化学物质进行分类时,除了纯净物外,还有一类是混合物。对混合物的研究,除了研究如何分离出纯净物和研究其中的某一成分的化学性质之外,还要研究混合物体系的特点。而对混合物体系的研究,也是当今化学领域中重要的研究内容,对于材料学有重要意义。
1、分散系
(1)定义:化学上把一种或多种物质以粒子的形式分散到另一种或多种物质中所形成的混合物。
分散系包括分散质和分散剂。分散质是指被分散成粒子的物质。

例如,CuSO4水溶液中,CuSO4是分散质,水是分散剂,CuSO4水溶液是分散系。
根据分散质粒子直径的大小将液体分散系分为:
①分散质粒子直径小于1nm的:溶液。(1nm=1╳10-9m)
②分散质粒子直径大于100nm的:浊液。
③分散质粒子直径为1~100nm的:胶体。
2、胶体
(1)定义:分散质粒子直径为1~100nm的分散系。
(2)根据分散剂的不同,分为:
①分散剂为气体的:气溶胶。如云、雾。
②分散剂为液体的:液溶胶。如Fe(OH)3胶体。
③分散剂为固体的:固溶胶。如有色玻璃。

(3)胶体与溶液的区分
胶体的外观难以与溶液区分,较稳定。
区分胶体和溶液的方法:用光束通过胶体时,可以在胶体内看到一条光亮的通路。

左侧CuSO4溶液,右侧Fe(OH)3胶体
这种现象叫丁达尔效应,这是由于胶体粒子对光线散射形成的。
(4)制取Fe(OH)3胶体:用烧杯加热煮沸40mL 蒸馏水,向沸水中加入5-6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl

(5)胶体粒子的分离方法:渗析。
采用的分离用具:半透膜。
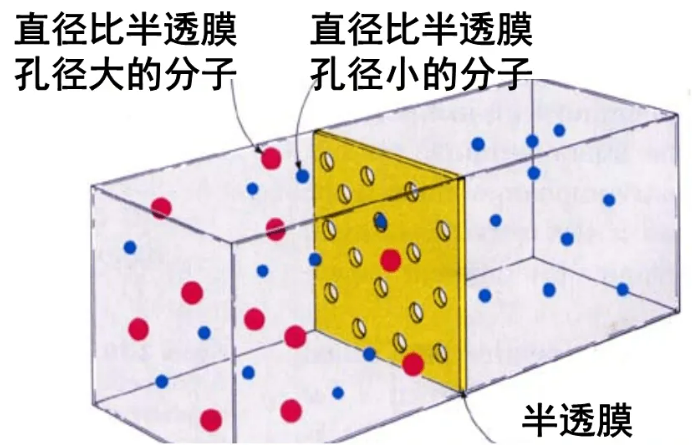
(6)胶体的一些其它性质
①电泳:一些胶体粒子带有电荷,在电场的作用下能发生定向移动。如Fe(OH)3胶体粒子带正电荷,通电时会向负极发生移动。

工厂中的静电除尘采用的就是这个原理。
②聚沉:胶体粒子在遇到电解质离子、带相反电荷的胶体粒子或加热等作用下,会转化为浊液,形成沉淀等。
豆浆制作豆腐采用的就是这个原理。

豆浆与水豆腐
三、物质的转化
1、酸、碱、盐的性质
(1)酸:
①与碱反应:反应原理是酸碱中和反应,生成盐和水。反应的原因是酸中显酸性的氢与碱中显碱性的氢氧根结合生成水。
HCl+NaOH= H2O+NaCl
②与碱性氧化物反应:反应原理与酸碱中和反应类似,生成盐和水。反应的原因是酸中显酸性的氢与碱性氧化物中的氧结合生成水。
2HCl+CuO= H2O+CuCl2
③与更弱的酸的盐反应:反应原理是强酸制取弱酸。
2HCl+CaCO3= H2O+CO2↑+CaCl2(碳酸是弱酸,分解为H2O+CO2)

④与某些生成难溶盐的物质反应:反应原理是生成难溶盐。
HCl+AgNO3=AgCl↓+HNO3
⑤与活泼金属发生置换反应生成氢气。
2HCl+Zn=ZnCl2+H2↑
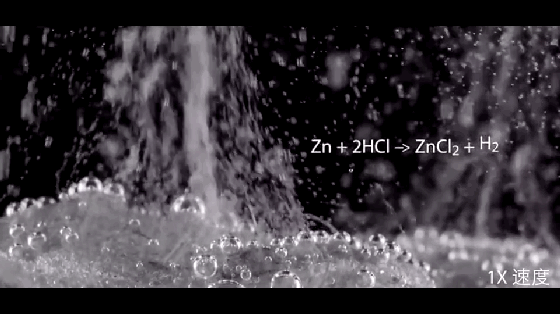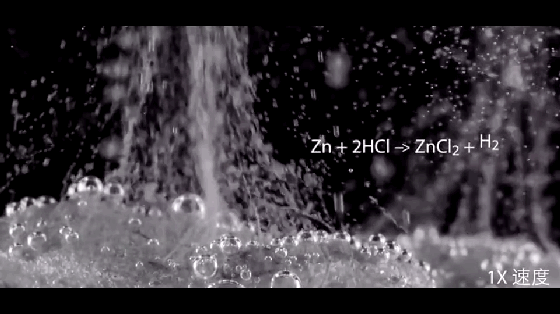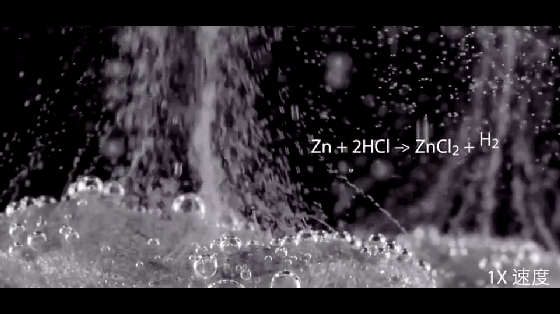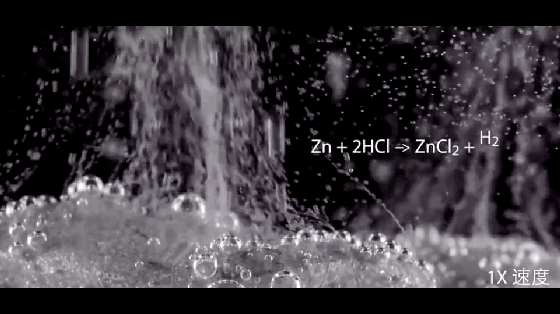
注意:硝酸与活泼金属反应不产生氢气。
(2)碱:
①与酸反应:反应原理是酸碱中和反应,生成盐和水。
②与酸性氧化物反应:反应原理与酸碱中和反应类似,生成盐和水。
CO2+2NaOH=Na2CO3+H2O
③与更弱的碱的盐反应:反应原理是强碱制取弱碱。
2NaOH+CuSO4= Cu(OH)2↓+Na2SO4

④与某些生成难溶盐的物质反应:反应原理是生成难溶盐。
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
(3)盐:
①弱酸盐与强酸反应:反应原理是强酸制取弱酸。
②弱碱盐与强碱反应:反应原理是强碱制取弱碱。
③易溶盐相互反应生成难溶盐。
BaCl2+Na2SO4= BaSO4↓+ 2NaCl
④与某些更活泼的金属发生置换反应。
CuSO4+Fe= Cu+FeSO4

(4)氧化物
酸性氧化物与碱或碱性氧化物反应。酸性氧化物与更弱的酸的盐反应。
碱性氧化物与酸或酸性氧化物反应。碱性氧化物与更弱的碱的盐反应。
2、物质的转化
化学物质的金属、非金属、氧化物、酸、碱、盐可以进行相互转化。
(1)金属-碱性氧化物-碱-盐的转化
Ca→CaO→Ca(OH)2→CaCl2
2Ca+O2=2CaO
CaO +H2O =Ca(OH)2
Ca(OH)2+2HCl = CaCl2+2H2O
【练习】写出Na的转化过程
(2)非金属-酸性氧化物-酸-盐的转化
C→CO2→H2CO3→CaCO3
C+O2 CO2
CO2
CO2+H2O = H2CO3
H2CO3+Ca(OH)2= CaCO3+2H2O
【练习】写出P的转化过程(提示:P2O5、H3PO4、Na3PO4)
3、在工业上,物质进行转化时,不仅要考虑反应的可能性,还要考虑原料来源、成本高低、设备要求、环境污染等,以选取最适当的方法。
如工业上制NaOH,一般不采用Na2O与H2O反应的方法,而是采用电解饱和食盐水的方法。

- 全部评论(0)
