化学反应历程与机理
时间:2023-09-19 15:42 来源:未知 作者:化学自习室 点击: 次 所属专题: 过渡态理论 基元反应 有效碰撞
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
(一)反应历程
1.化学动力学与反应历程
化学动力学是研究化学反应进行的速率和反应历程(即机理)的科学。所谓反应历程就是反应物按什么途径,经过哪些步骤,才能转化为最终产物。
选择适当的反应途径,可以使热力学由预期转变为现实。
2.基元反应与非基元反应
例如H++OH-===H2O,反应几乎没有过程,瞬间平衡一步到位,称为简单反应或基元反应;而2HI===H2+I2的实际机理是分两步进行的,每一步都是一个基元反应:2HI―→H2+2I·、2I·―→I2,存在未成对电子的微粒称为自由基,反应活性高,寿命短,2HI===H2+I2称为非基元反应。
(二)有效碰撞理论与活化能
| 活化能 | 活化分子数 | 单位体积内活化分子数 | 有效碰撞 | |
增大浓度/压强 | 不变 | 不变 | 增多 | 增加 |
升高温度 | 不变 | 增多 | 增多 | 增加 |
催化剂 | 下降 | 增多 | 增多 | 增加 |
(三)过渡态与中间体
1.过渡态
A+B-C―→[A…B…C]―→A-B+C
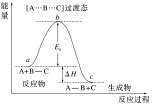
备注:(1)以上为一种基元反应,其中正反应活化能Ea正=B-A,逆反应活化能Ea逆=B-C,ΔH=Ea正-Ea逆。(2)过渡态(A…B…C)不稳定。
2.中间体
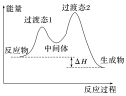
备注:处于能量最高点的是反应的过渡态,在多步反应中两个过渡态之间的是中间体,中间体很活泼,寿命很短,但是会比过渡态更稳定些。
(四)能垒与决速步
能垒:可以简单理解为从左往右进行中,向上爬坡吸收的能量,而包含最高能垒的反应我们称之为决速步骤,也称为慢反应。
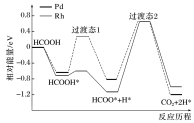
例如图中,从第一个中间体到过渡态2的能量就是最高能垒,而HOO×+H×===CO2+2H×是在Rh做催化剂时该历程的决速步骤。
(五)催化剂与中间产物
催化剂:在连续反应中从一开始就参与了反应,在最后又再次生成,所以仅从结果上来看似乎并没有发生变化,实则是消耗多少后续又生成了多少。
中间产物:在连续反应中为某一步的产物,在后续反应中又作为反应物被消耗,所以仅从结果上来看似乎并没有生成,实则是生成多少后续又消耗多少。
在含少量I-的溶液中,H2O2分解的机理为
H2O2+I-―→H2O+IO- 慢
H2O2+IO-―→O2+I-+H2O 快
在该反应中I-为催化剂,IO-为中间产物。
而在机理图中,先找到确定的反应物,反应物一般是通过一个箭头进入整个历程的物质(产物一般多是通过一个箭头最终脱离这个历程的物质),与之同时反应的就是催化剂,并且经过一个完整循环之后又会生成;中间产物则是这个循环中的任何一个环节。

考向二 无机反应机理图分析



- 全部评论(0)
