为什么ZnS溶于酸,而CuS不溶于酸?
时间:2023-11-14 16:35 来源:未知 作者:化学自习室 点击:次 所属专题: 溶度积计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
计算0.01mol ZnS溶于1.0L 盐酸中,所需盐酸的最低浓度?
查表可知:Ksp(Zns)=2.0×10-24; Ksp(CuS)=6.3×10-36; H2S:Ka1=1.3×10-24; Ka2=1.3×10-15
根据多重平衡规则可推算出总反应的平衡常数K为
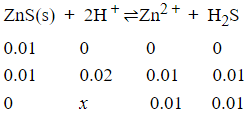
K=Ksp/(Ka1·Ka2)=(0.01)2/x2
x=0.21
故所需盐酸的最低浓度为0.23mol/L
同理:
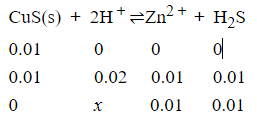
K=Ksp/(Ka1·Ka2) =(0.01)2/x2
所需盐酸的最低浓度为1.0×109mol/L.(这种浓度的盐酸根本不可能存在)
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
