常见配体中配位原子总结
时间:2024-04-07 09:11 来源:未知 作者:化学自习室 点击:次 所属专题: 配体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、常见的配位原子
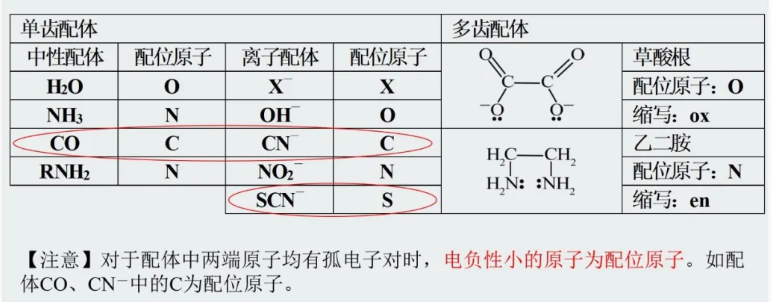
说明:
CO:偶极矩的测定数据颇能说明问题。尽管C和O电负性差值较大(碳2.55.氧3.44),但实际上CO 偶极矩很小,μ=0.11D,且C原子一端略呈负电性。CO的这种反常性是因为其碳分子中有一个配位键, 一对电子完全由O原子提供。这样抵消了C和O间由于电负性差而引起的极性,致使偶极矩很小,且碳氧间电子云向碳方偏移,C上带较多负电荷。显然,易于提供孤对电子的原子是C而不是O,C是CO 配体中的配位原子。
CN-:与CO属等电子体, 结构类似。尽管N的电负性较大,但碳氮间电子云偏向于C原子,致使C原子更易提供孤对电子。故氰根离子作配体时,C在绝大多数情况下都是配位原子。
SCN-(硫氰根)、NCS-(异硫氰根):两种结构中,只有S和N都有孤对电子。两种结构中的电子分布差别较小。实际上,在一定条件下两种结构极易转化。何种原子作配位原子,与配位的中心原子有关。一般而言,当与第一系列过渡元素配合时,氮原子作配位原子,此时配体称异硫氰根:当与第二、三系列过渡元素配合时,硫原子作配位原子,此时配体称硫氰根。

二、配位数
中心原子/离子的配位数:[Ag(NH3)2]+、[Cu(NH3)4]2+、[Cu(H2O)4]2+、 [Zn(CN)4]2-、 Fe(CN)6]3 -
一般规律:一般配合物的配位数可以按中心离子电荷数的二倍来计算
中心离子的电荷高,对配体的吸引力就越强,有利于形成高配位数的配合物:
中心离子的半径越大,其周围可容纳的配体就越多,配位数越大。
中心离子的电荷 | +1 | +2 | +3 | +4 |
常见配位数 | 2 | 4(或6) | 6(或4) | 6(或8) |
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
