甲基橙作指示剂误差究竟有多大?
时间:2010-12-23 09:14 来源:未知 作者:孙远征 点击:次 所属专题: 甲基橙 指示剂选择
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
现行高中化学教材第二册(人教版),酸碱中和滴定的指示剂仅选择了酚酞,有些人认为不选甲基橙的原因是使用甲基橙时的误差太大。对于强酸、强碱之间的中和滴定,使用甲基橙和酚酞的误差到底有多大呢?我们不妨以0?1 mol/L 的NaOH和0?1 mol/L HCl之间的滴定为例,通过计算来说明一下。
?
1 从理论上讲?
(1)计算0.1 mol/L的NaOH滴定0.1 mol/L HCl至甲基橙变黄(pH=4.4)和酚酞变红(pH=9.0)的终点误差。[注:指示剂在变色间隔内有一点变色特别明显,这一点也就是实际滴定的终点,称为指示剂的滴定指数。pH=4.4和pH=9.0是上述滴定过程最明显的变色点]?

由于在观察变色点时,因人而异会有0.3 pH出入。所以,考虑到这一点,误差可能稍微增大:?
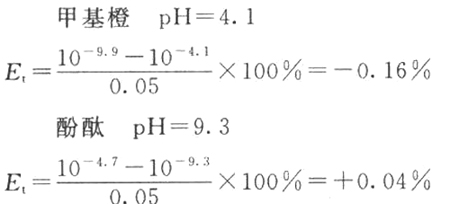
(2)计算0.1 mol/L的HCl滴定0.1 mol/L NaOH至甲基橙由黄变橙(pH=4.0)和酚酞由红变无色(pH=9.0)的终点误差。[注:pH=4.0和pH=9.0是上述滴定过程最明显的变色点]?
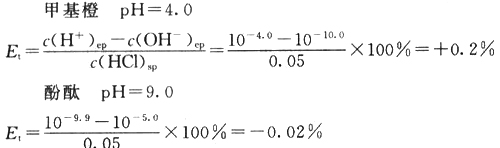
由于在观察变色点时,因人而异会有0.3 pH出入。所以,考虑到这一点,误差可能稍微增大:?

通过上面的讨论,我们看到从理论上讲,在强酸、强碱中和滴定时,无论是使用酚酞还是甲基橙做指示剂,滴定误差均很小(小于0.5%在误差允许范围之内),且酚酞做指示剂误差会更小。?
2 从操作上讲?
在实际的滴定操作过程中,我们很难把滴定终点的pH控制在滴定指数的数值上。由于,最后的滴定一般采取“半滴”滴加的方法,且实际滴定终点时pH要达到或越过滴定指数的数值,所以,实际滴定终点时滴定剂最多比理论滴定终点(滴定指数)多半滴。现在,我们把过量因素考虑进去,再来分析一下滴定的终点误差。?

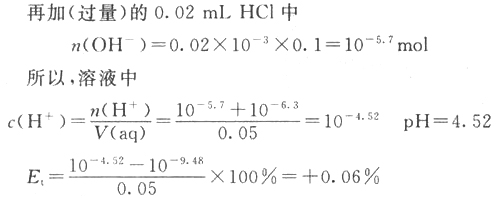
从上面的计算可知,在进行强酸、强碱中和滴定的实际操作中,无论使用酚酞还是甲基橙做指示剂,滴定终点误差都小于0.5%,并且甲基橙做指示剂的误差并不一定大于?酚酞。??
综上所述,对于上述条件下强酸、强碱之间的中和滴定实验,使用甲基橙做指示剂的误差最大不过0?4%,严格在误差允许范围之内,所以,无论选择酚酞还是甲基橙做指示剂,系统误差都很小,都是非常好用的指示剂。之所以,现行教材中单独使用了酚酞这种单色指示剂,笔者认为原因可能是:①变色点易于观察,②使问题简单化(降低教材难度)。认为使用甲基橙误差太大的观点,显然是站不住脚的。?
参考文献?
[1] 人民教育出版社化学室?化学(第二册)?北京:人民教育出版社,2003:67-70?
[2] 彭崇慧等?定量分析简明教程.第2版,北京:北京大学出版社,1997:114-120

- 全部评论(0)
