守恒作为自然界的普遍规律,是人类征服改造自然的过程中对客观世界抽象概括的结果。在物质变化的过程中守恒关系是最基本也是本质的关系之一,化学的学习若能建构守恒思想,善于抓住物质变化时某一特定量的固定不变,可对化学问题做到微观分析,宏观把握,达到简化解题步骤,既快又准地解决化学问题之效。守恒在化学中的涉及面宽,应用范围极广,熟练地应用守恒思想无疑是解决处理化学问题的重要方法工具。
一、质量守恒
1、物质质量守恒
应用关键:抓住参加反应的各种物质的总质量恒等于生成物的总质量。
[例1]将氯酸钾和二氧化锰的混合物20克平铺在试管底部,进行充分加热至质量不再改变,冷却后。将残余全部固体在t℃加入10克水中充分搅拌,发现有7.8克固体未溶解。保持温度不变,再加入5克水,仍有5克固体未能溶解。
(1)加热时发生的化学反应方程式为
(2)若最后未溶解的固体为混和物,则转移了 mol电子。此温度下KCl的溶解度是 克。
(3)若未溶解固体为纯净物,则生成气体在标准状况下是 L。此温度下KCl溶解度是 克。
[思路解析]、题目考查学生用物质质量守恒和相关溶解度知识分析解决问题的能力。
①、化学方程式:2KClO3====2KCl + 3O2↑
②、未溶解的固体为混和物时,即含有KCl、MnO2,则两次加水均形成饱和溶液。15克水中共溶解的KCl是(7.8–5)g×3 = 8.4g,m(O2)=20g-(8.4+5)g=6.6g,转移的电子数为:[ 6.6g÷32g/mol]×4=1.65mol, 设溶解度为S(KCl), 则有:
S(KCl)/100g = 8.4g/15g, S(KCl)=56g。
③ 若未溶物是纯净物时,即其为不溶解的MnO2,质量是5克.
2KClO3====2KCl + 3O2↑
245g 22.4×3L
(20-5)g V(O2)
|
V(O2)=15g×22.4×3L/245g=4.11L
在此温度下,第一次加水后再加水固体仍有溶解,故第一步加水形成了饱和溶液,且溶解的KCl的质量是:
(20g-4.11/22.4×32g-7.8g)=6.32g,由S(KCl)/100g=6.32g/10g S(KCl) = 63.2g
2、元素质量守恒
应用关键:把化学反应中同种元素质量前后不变作为解题依据的思维方法。
[例2]、(2000年高考广东卷)取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁的混和物的总质量为0.470克.冷却后,加入足量水,将反应产物蒸干并灼烧,得到氧化镁的质量是0.486g.
(1)、写出氮化镁与水反应生成氢氧化镁和氨的化学方程式: 。
(2)、燃烧后所得的固体混和物中氮化镁的质量分数 。
[思路解析]、(1)Mg3N2 + 6H2O=3Mg(OH)2 + NH3↑
(2)、由镁元素的质量守恒,则有:
0.470g×w(Mg3N2)×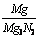 ×100% +0.470×[1-w(Mg3N2)]
×100% +0.470×[1-w(Mg3N2)]×
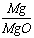 ×100% =0.486×
×100% =0.486×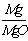
×
100% 解之得 w(Mg3N2)=0.17×100% = 17% 3、原子的物质的量守恒
应用关键:物质变化中的某种原子无论以多少种形式存在,其总物质的量恒定不变(即物料守恒)。
[例3]、(2004年高考上海卷-31)黄铜矿(主要成份是CuFeS2)是提取铜的主要原料.
(1)、取12.5g黄铜矿样品,经测定含有3.60g硫(杂质不含硫),矿样中CuFeS2的含是 。
(2)、巳知
2CuFeS2 + 4O2  CuS2 + 3SO2 + FeO(炉渣),产物CuS2在1200℃高温下继续反应:
CuS2 + 3SO2 + FeO(炉渣),产物CuS2在1200℃高温下继续反应: 2Cu2S+3O2  2Cu2O+2SO2
2Cu2O+2SO2
2Cu2O + Cu2S  6Cu+SO2
6Cu+SO2
假定各步反应都完全,完成下列计算
①、6mol CuFeS2生成6molCu,求消耗O2的物质的量
②、6mol CuFeS2和14.25mol O2 反应,理论上得到多少铜?
③、6mol CuFeS2和15.75mol O2反应,理论上得到多少摩尔铜?
[思路解析]、此题考查学生进行过量计算和利用原子守恒分析解决问题的能力。
(1)由硫元素守恒,12.50g×w(CuFeS2)×2S/CuFeS2×100%=3.6g 解出w(CuFeS2)=82.8%
(2)、①6molCuFeS2要生成6molCu,从反应方程式可以得出理论上需要的O2中的氧原子的物质的量,等于6molCuFeS2中的Fe、S完全被氧化成FeO、SO2中时结合的氧原子的量。即
n(O2)=[n(FeO) +2n(SO2)] ×1/2
={6mol+12mol×2}×1/2
=15mol
②由第二问计算可知
:6molCuFeS2和14.25mol O2反应时,O2量不足。第一步消耗O2 为12mol。根据第二步、第三步反应得出两步的总反应式: CuS2 + O2  2Cu + SO2
2Cu + SO2 应以不足的氧气余量(14.25-12)mol=2.25mol计算。故生成铜为:
n(Cu) = 2n(O2) = 2.25mol×2 = 4.5mol
③
6molCuFeS2和15.75mol O2反应时,O2过量。从第二步反应可看出过量氧气中的氧原子将铜氧化为Cu2O,由关系式O2  2Cu2O
2Cu2O  4Cu,故生成的铜为:
4Cu,故生成的铜为: [6mol-(15.75-15)mol×4]=3mol
二、电子转移守恒
任何一个氧化还原反应,氧化剂得到的电子总数总是等于还原剂失去的电子总数,从整体出发,利用这一规律解决氧化还原反应中的众多问题,可简化解题过程。
[例4]、1.92克铜粉投入到适量的浓硝酸中,完全溶解后,共收集到标准状况下的气
体1.12L,如将此气体通过足量的水中,最后余下的气体在标准状况下是( )
A、448mL B、560mL C、224mL D、896mL
[思路解析]、从整体出发,最终得到NO, 则生成NO时共得到的电子总数等于铜失去的电子总数,可避开数据1.12L的干扰。
V(NO)/22.4mol·L-1 ×3=1.92g/64mol•L-1 V(NO)=0.448L=448mL 答案选A。
三、电荷守恒
任何一种物质或体系,前后的净电荷总数是不变的。用电荷守恒对溶液或者在溶液中的化学反应进行相关分析,是优化解题过程的一种常用途径,其包括两个方面:
1、电中性原理
[例5]、将两个铂电极插入500mL CuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064克。(设电解中无H2放出且不考虑水解和溶液体积的变化)。此时H+的浓度为( )
A、4×10-3 mol·L-1 B、2×10-3 mol·L-1
C、1×10-3 mol·L-1 D、1×10-7 mol·L-1
[思路解析] 由电中性原理,CuSO4中的Cu2+电解为Cu后所缺少的正电荷由生成的H+来补充,故n(H+)=n(Cu2+)少×2=0.064g/64g.mol-1 ×2=2×10-3mol
c(H+)=2×10-3mol÷0.5L=4×10-3 mol·L-1 故C答案符合题意。
2、离子反应中:反应前后微粒净电荷总数守恒
[例6]、在一定条件下,RO3n-和I-发生反应的离子方程式如下:
RO3n- + 6I-+ 6H+=R-+ 3I2 + 3H2O
(1)RO3n-中的R元素的化合价是 。
(2)R是 (填金属或非金属) 元素,理由是 ,应属于 族。
[思路解析] (1)由前后微粒的净电荷数守恒: -n + (-1)×6(+1)×6=-1 得n=1,故R的化合价为+5。
(2)因金属元素一般无负价, 故R是非金属元素,最低价为-1价,属ⅦA。
四、浓度守恒
在一定温度下,同种物质的饱和溶液的浓度与饱和溶液量的多少无关,为一恒值,它是该温度下此种物质浓度的最大极限。
[例7]、20℃时在100克饱和澄清石灰水中加入5.6克生石灰充分溶解后恢复到原温度,以下说法中正确的是( )
A、产生7.4克不溶物 B、溶液的质量为98.2克
C、溶液中的c(H+)不变 D、溶液中的n(Ca2+)不变
CaO + H2O = Ca(OH)2
56g 18g 7.4g
5.6g m(H2O) m[Ca(OH)2]
|
|
[思路解析] 、温度一定, 因饱和溶液中的c(Ca2+)、c(OH-)不变,则c(H+)不变。由生石灰的变化情况为:
解之得 m(H2O)=1.8g , m[Ca(OH)2]=7.4g
故原饱和溶液中的溶剂量减少,不仅不能溶解固体反而要析出溶质, 使不溶物质量大于7.4克,溶液的质量小于98.2克,溶液中的n(Ca2+)的量变小,只有C答案正确。
五、水的离子积守恒
在一定的温度下,任意物质水的稀溶液中,水的离子积Kw恒定不变。这是我们分析解决溶液中H+和OH-关系与PH值计算的重要依据.
[例8]某温度(t℃)时,水的离子积为Kw=1×10-13 则此温度 (填大于、等于或少于)25℃,理由是 ,将此温度下PH=11的苛性钠溶液a L与PH=1的稀硫酸b L混和(设混和后溶液体积的微小变化忽略不计),试通过计算填写下列不同情况时两种溶液的体积比:
(1)若所得混和溶液为中性,则a:b= 此种溶液中离子浓度由大到小的顺序是
(2)若所得混和溶液的PH=2,则a:b= 则此种溶液中各种离子的浓度由大到小的顺序是 。
[思路解析]在25℃时水的Kw=1×10-14,现水的Kw增大, 水的电离被促进,温度升高,应填大于。
(1) 因t℃水的离子积守恒, 由PH=11的苛性钠溶液和PH=1的硫酸溶液混和后为中性,生成Na2SO4的水溶液,两溶液中的n(OH-)=n(H+)即a L×10-13/10-11mol.L-1=b L×10-1mol.L-1 a:b=10:1 溶液中离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)=c(OH-)
(2)因t℃时水的离子积不变,在溶液为中性时c(H+)=1×10-6.5mol.L-1, 现所得溶液的PH=2,c(H+)=1×10-2mol.L-1>1×10-6.5mol.L-1,硫酸过量。则
(a + b) L×
10-2mol.L-1=b L×10-1mol.L-1-10-13/10-11mol.L-1×a L 则a:b=9:2 此时的混和溶液中,c(H+)=1×10-2mol.L-1 ×10-2mol.L-1 c(SO42-)=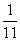 ×10-1mol.L-1c(Na+)=
×10-1mol.L-1c(Na+)=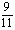
故c(H+)>c(SO42-)>c(Na+)>c(OH-)
六、溶质守恒
同种溶质的溶液混和或溶液稀释,这种溶质的总量恒定是解决溶液问题的根本依据。
[例9]有100克浓度为18mol.L-1的浓硫酸,其密度为d g/mL, 加水稀释至9mol.L-1,则加入的水的体积为( )
A、100mL B、100/d mL C、大于100mL D、小于100mL
[思路解析]设稀释后的溶液的密度为d(稀),加水为VmL,抓住稀释前后的n(H2SO4)不变,则有:
18mol.L-1×100g/dg.mL-1×10-3L/mL =9mol.L-1×[(100g+VmL×1g/mL)÷d(稀)]×10-3L/mL
V=200d(稀)/d -100
因硫酸的浓度越小密度越小,d(稀)/d的值小于1,故加水的体积小于100mL,答案选D。
七、溶液中质子守恒
含义:在一种物质的水溶液中由水电离产生的H+和OH-无论以何种形式存在,二者的量总恒为相等。
[例10]在0.1mol.L-1 Na2CO3溶液中,下列关系式中不正确的是( )
A、c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) B、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
C、c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) D、c(Na+)+2c(H2CO3)+c(HCO3-)=2c(CO32-)+c(OH-)
[思路解析]A答案符合物料守恒n(Na+)=2n(C),B答案符合电荷守恒。因CO32-的水解,消耗了水电离出的部分H+,故溶液中的H+及其转化生成的HCO3-、H2CO3中的H+的总量恒等于OH-,C答案也正确,不符合题意的是D。
八、质子数守恒
一种微粒,无论是得到还是失去电子,微粒中的质子总数总等于各种原子的质子数之和。
[例11]今有W克RO3n-中共有a个质子,b个电子,若R原子的核内质子数数等于中子数,则R原子的核是电荷数为 (用含W、n、a、b的代数式表示)。
九、气体体积守恒
同温同压下任意气体间相互混合(互不反应)时,相同条件下混合气体的体积等于各气体的体积之和。
[例12](2005全国卷Ⅲ-12)在273K和101kP的条件下,将2.00克氦气、1.40克氮气、和1.60克氧气混合,该混合气体的体积是( )
A.6.72L B.7.84L C.10.08L D.13.44L
[思路解析] 273K和101kP的条件下即就是我们所说的标准状况下.条件不变,气体的总体积等于各气体的体积之和(氦气为单原子分子):
(2.00g/2g.mol-1 + 1.40 g/28g.mol-1 + 1.60 g/32g.mol-1)ⅹ22.4L.mol-1 =13.44L
故本题答案选D

