化工生产和生活中的化学专题
时间:2017-09-22 22:15 来源: 作者:吴传鹏 点击:次 所属专题: 化工生产 化学与生活
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【考试大纲要求】
1.掌握硫酸和硝酸的制备原理、性质、用途。
2.了解常见化肥的基本性质。
3.能够通过对自然界、生产、生活中的化学现象的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆。
4.能将实际问题(或题设情境)分解,找出解答的关键。能够运用自己存储的知识,将它们分解、迁移转换、重组,使问题得到解决的应用能力。
【知识规律总结】
中学化学涉及的化工生产有:①硫酸和硝酸,②硅酸盐,③炼铁、炼钢、炼铝,④石油化工、煤加工、农副产品化工,⑤合成氨,⑥氯碱工业等。化工生产中的废弃物如不加工处理会造成环境污染。
化学与生活的联系,随着人们生活水平的提高日趋密切,生活中的化学知识到处可见。在高考化学试题中,对这方面的知识也进行了一定程度的考查。现将日常生活中的化学问题列举如下:
一、用无铅汽油——开车人的选择
使用含铅汽油的汽车会通过尾气排放出铅。这些铅粒随呼吸进入人体后,会伤害人的神经系统,还会积存在人的骨骼中;如落在土壤或河流中,会被各种动植物吸收而进入人类的食物链。铅在人体中积蓄到一定程度,会使人得贫血、肝炎、肺炎、肺气肿、心绞痛、神经衰弱等多种疾病。
二、买环保电池——防止汞镉污染
我们日常使用的电池是靠化学作用,通俗地讲就是靠腐蚀作用产生电能的。而其腐蚀物中含有大量的重金属污染物——镉、汞、锰等。当其被废弃在自然界时,这些有毒物质便慢慢从电池中溢出,进入土壤或水源,再通过农作物进入人的食物链。这些有毒物质在人体内会长期积蓄难以排除,损害神经系统、造血功能、肾脏和骨骼,有的还能够致癌。电池可以说是生产多少废弃多少;集中生产,分散污染;短时使用,长期污染。
三、自备餐盒——减少白色污染
环境保护浪潮使生产一次性产品的行业正在走下坡路,很多国家在开发生产可降解塑料,使其在使用过后能够在自然界中化解;有的国家已淘汰使用塑料,而用特种纸包装代替。很多国家提倡包装物的重复使用和再生处理。丹麦、德国规定,装饮料的玻璃瓶使用后经过消毒处理可多次重复使用,瑞典一家最大的乳制品厂推出一种可以重复使用75次的玻璃奶瓶;一些发达国家把制造木杆笔视为“夕阳工业”,开始生产自动铅笔。
四、慎用清洁剂——尽量用肥皂,减少水污染
大多数洗涤剂都是化学产品,洗涤剂含量大的废水大量排放到江河里,会使水质恶化。长期不当的使用清洁剂,会损伤人的中枢系统,使人的智力发育受阻,思维能力、分析能力降低,严重的还会出现精神障碍。清洁剂残留在衣服上,会刺激皮肤发生过敏性皮炎,长期使用浓度较高的清洁剂,清洁剂中的致癌物就会从皮肤、口腔处进入人体内,损害健康。
五、选无磷洗衣粉——保护江河湖泊
我国生产的洗衣粉大都含磷。我国年产洗衣粉200万吨,按平均15%的含磷量计算,每年就有7万多吨的磷排放到地表水中,给河流湖泊带来很大的影响。据调查,滇池、洱海、玄武湖的总含磷水平都相当高,昆明的生活污水中洗衣粉带入的磷超过磷负荷总量的50%。大量的含磷污水进入水源后,会引起水中藻类疯长,使水体发生富营养化,水中含氧量下降,水中生物因缺氧而死亡。水体也由此成为死水、臭水。
六、珍惜纸张——就是珍惜森林与河流
纸张需求量的猛增是木材消费增长的原因之一,全国年造纸消耗木材1000万立方米,进口木浆130多万吨,进口纸张400多万吨,这要砍伐多少树木啊!纸张的大量消费不仅造成森林毁坏,而且因生产纸浆排放污水使江河湖泊受到严重污染(造纸行业所造成的污染占整个水域污染的30%以上)。
七、替代贺年卡——减轻地球负担
礼节繁多的日本人近年来也在改变大量赠送贺年卡的习惯。一些大公司登广告声明不再以邮寄贺年卡表示问候。我国的大学生组织了“减卡救树”的活动,提倡把买贺卡的钱省下来种树,保护大自然。
八、回收废电池——防止悲剧重演
“痛痛病”和“水俣病”都是在日本发生的工业公害病。这是由于含镉或汞的工业废水污染了土壤和水源,进入了人类的食物链。“水俣病”是汞中毒,患者由于体内大量的积蓄甲基汞而发生脑中枢神经和末梢神经损害,轻者手足麻木,重者死亡。“痛痛病”是镉中毒,患者手足疼痛,全身各处都很容易发生骨折。得这种病的人都一直喊着“痛啊!痛啊!”,直到死去,所以被叫做“痛痛病”。由于普通干电池都含有这两种有毒金属元素,所以说电池从生产到废弃,时刻都潜伏着污染。电池的回收势在必行!
九、催熟水果
家里如果有青香蕉、绿桔子等尚未完全成熟的水果,要想把它们尽快催熟而又没有乙烯,可以把青香蕉等生水果和熟苹果等成熟的水果放在同一个塑料袋里,这样,不几天青香蕉就可以变黄、成熟。这是因为,水果在成熟的过程中,自身能放出乙烯气体,利用成熟水果放出的乙烯可以催熟生水果。
十、碘化合物与人体健康
碘化钾、碘化钠、碘酸盐等含碘化合物,在实验室中是重要试剂;在食品和医疗上,它们又是重要的养分和药剂,对于维护人体健康起着重要的作用。
碘是人体内的一种必需微量元素,是甲状腺激素的重要组成成分。正常人体内共含碘15~20mg,其中70~80%汇集在甲状腺内。人体内的碘以化合物的形式存在,其主要生理作用通过形成甲状腺激素而发生作用。因此,甲状腺素所具有的生理作用和重要机能,均与碘有直接关系。
人体缺乏碘可导致一系列生化紊乱及生理功能异常,如引起地方性甲状腺肿,导致婴、幼儿生长发育停滞、智力低下等。
值得注意的是,人体摄入过多的碘也是有害的,是否需要在正常膳食之外特意“补碘”,要经过正规体检,听取医生的建议,切不可盲目“补碘”。
食用碘盐应注意如下几个方面:
1.少买及时吃。少量购买,吃完再买,目的是防止碘的挥发。因碘酸钾在热、光、风、湿条件下会分解挥发。
2.忌高温。在炒菜做汤时忌高温时放碘盐。炒菜爆锅时放碘盐,碘的食用率仅为10%,中间放碘盐食用率为60%;出锅时放碘盐食用率为90%;拌凉菜时放碘盐食用率为100%。
3.忌在容器内敞口长期存放。碘盐如长时间与阳光、空气接触,碘容易挥发。最好放在有色的玻璃瓶内,用完后将盖盖严,密封保存。
4.忌加醋。碘跟酸性物质结合后会被破坏。据测试,炒菜时如同时加醋,碘的食用率即下降40%~60%。另外,碘盐遇酸性莱(如酸菜),食用率也会下降。
十一、氟化合物与人体健康
氟是人体中的一种必需微量元素。在人体必需元素中,人体对氟含量最为敏感,从满足人体对氟的需要到由于氟过多而导致中毒的量之间相差不多,因此氟对人体的安全范围比其他微量元素窄得多。所以要更加注意自然界、饮水及食物中氟含量对人体健康的影响。
氟在人体中主要分布在骨胳、牙齿、指甲和毛发中,尤以牙釉质中含量多,氟的摄入量或多或少也最先表现在牙齿上。当人体缺氟时,会患龋齿,氟多了又会患斑釉齿,如果再多,会患氟骨症等系列病症。
市场上出售的加氟牙膏含有氟化钠、氟化锶等氟化合物,有防龋作用,适用于缺氟地区。是否需要选用这种牙膏,最好听取卫生部门或牙医的建议。
十二、甘油的妙用
冬天气候寒冷、干燥,手和脸部的皮肤容易破裂,如果涂擦一些甘油可保持皮肤滋润。但是不能使用纯甘油,因为它具有吸湿性,能吸收表皮的水分,从而使皮肤更易干裂。如果以4/5体积甘油与1/5体积水混合后再涂擦皮肤,就可以起到护肤作用。
十三、高锰酸钾的杀菌消毒作用
高锰酸钾俗称灰锰氧,是一种有结晶光泽的紫黑色固体。高锰酸钾易溶于水,溶液呈鲜艳的紫红色。高锰酸钾水溶液能使细菌微生物组织因氧化而破坏。因而它具有杀菌消毒作用。0.1%的高锰酸钾溶液可用来洗涤伤口;也可用来消毒碗筷、茶杯等餐具、茶具和水果。使用高锰酸钾消毒水果、餐具等物品时,先将欲消毒物品放入高锰酸钾溶液中浸泡数分钟,然后用清水冲洗干净即可。
使用高锰酸钾溶液消毒时注意,溶液要现用现配,放置时间长了,消毒效果会降低,当溶液变为棕黄色时,就完全失效了。
十四、警惕氢气球(或气罐)爆炸造成伤亡
初中化学教材在“氢气的性质和用途”一节中介绍了氢气的燃烧及氢气与空气混合气的爆炸演示实验,并指出,如果反应在密闭的或容积大而口小的容器内进行,气体(指氢气和空气的混合气体)不能排出或来不及排出,就会爆破容器,发生危险。强调在使用氢气时,要特别注意安全。点燃氢气前,一定要检验氢气的纯度。检验氢气的纯度不但编有演示实验,而且还有学生实验。如果严格按照教材上的内容做,是不会发生问题的。
但前些年来,各种报纸上刊载过若干起氢气球大爆炸,引起大量群众,特别是学生被炸伤、烧伤的严重事故。引起爆炸的原因,大概有以下几种:1.用打火机去烧系气球的牵绳;2.鞭炮与氢气球“狭路相逢”;3.哄抢气球中吸烟;4.自制气球气罐爆炸;5.广告气球氢气逸出撞车爆炸,等等。
【思维技巧点拨】
例1 市售家用消毒液发生器是利用常见的精盐和自来水为反应物。通直流电时,器中电解槽内的极板上产生大量气泡,闻有刺激性氯气味;切断电源后所得消毒液具有强烈的杀菌能力,且对人体无毒副作用。写出该发生器中主要发生的化学方程式_______________________。
解析 此题主要考查了电解原理和元素化合物的知识在日常生活中的反应。
电解精盐溶液时,反应的化学方程式为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑,
2NaOH+Cl2↑+H2↑,
从电解槽内放出的Cl2又与H2O和NaOH分别发生如下反应:Cl2+H2O=HCl+HClO,Cl2+2NaOH=NaCl+NaClO+H2O,HClO的强氧化性可杀菌消毒。
答案:2NaCl+2H2O 2NaOH+Cl2↑+H2↑,,Cl2+2NaOH=NaCl. NaClO+H2O(Cl2+H2O
2NaOH+Cl2↑+H2↑,,Cl2+2NaOH=NaCl. NaClO+H2O(Cl2+H2O![]() HCl+HClO)
HCl+HClO)
例2 含苯酚的工业废水处理的流程图如下:
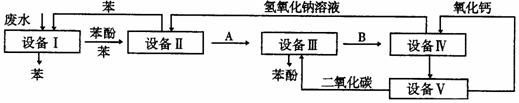
(1)上述流程里,设备Ⅰ中进行的是____________操作(填写操作名称)。实验室里这一步操作可以用_______________________进行(填写仪器名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是____________,由设备Ⅲ进入设备Ⅳ的物质B是____________。
(3)在设备Ⅲ中发生反应的化学方程式为:_______________________。
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和____________。通过____________操作(填写操作名称),可以使产物相互分离。
(5)上图中,能循环使用的物质是C6H6、CaO、____________、____________。
解析 (1)含苯酚的工业废水通过设备Ⅰ,在苯的作用下得到苯和苯酚的混合物,弃去水,进行的操作应该是萃取和分液。实验室里这一步操作可用分液漏斗进行。(2)在设备Ⅱ中,苯酚和NaOH溶液发生反应生成苯酚钠和水(方程式略)。苯重回设备Ⅰ循环利用。苯酚钠进入设备Ⅲ,所以A是C6H5ONa。向设备Ⅲ中通入CO2有苯酚生成,所以B为NaHCO3。(3)方程式略。(4)设备Ⅳ中发生的反应为:CaO+H2O=Ca(OH)2,NaHCO3+Ca(OH)2=NaOH+H2O+CaCO3↓。通过过滤可将CaCO3沉淀和NaOH溶液分离。(5)NaOH CO2。
例3 合成类固醇是奥委会于1984年公布的违禁药之一。从结构上看,合成类固醇是一类含有环戊烷多氯菲核(见Ⅰ式)基本结构的化合物。之所以属违禁药物,是因为它的一种17α-烷基作睾酮衍生物如康力龙(见Ⅱ式),其分子中17a碳上烷基的作用,此种药物对肝功能有明显的损害作用,过量使用还会产生女子男性化,男子过早秃顶,肝中毒甚至肝癌等毒副作用。
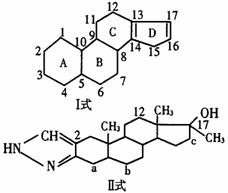
请回答:
(1)用(Ⅰ)式中给碳位编号的方法试着给(Ⅱ)式碳原子定位,其中a位是____________、b位是____________、c位是____________。
(2)康力龙分子中共有____________个碳原子,分子结构的不饱和度Ω=____________。
(3)已知(Ⅰ)式能使溴水褪色,写出其可能产物的结构简式[未参加反应的碳环可略去不写,但要在所写产物的结构简式中标明碳环编号(用A、B…表示),在反应部位的碳原子上至少标明碳位一处。可不填满,也可补充]:① ,② ,③ ,……
解析 因Ⅱ式是Ⅰ式的衍生物,可首先对比二者结构的异点。由结构的相同点及Ⅰ式的碳位编号方法可知a位为4,b位是6,c位为16。由结构的不同点可知,Ⅱ式的17位、13位和10位各比Ⅰ式多一个甲基,且在2、3位又衍生出一个只含一个碳原子的环,因此,Ⅰ式为17个碳,则Ⅱ式为21个碳。且Ⅱ式含5个环,二个双键,所以其不饱和度为7。Ⅰ式与Br2等物质的量加成,有三种加成产物,即13-14加成,17-16加成和14-16加成,Ⅰ式与Br2按物质的量之比为1∶2加成,则产物只有一种。
答案 (1)4 6 16 (2)21 7

例4 碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者也大约有1000万人左右。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题。
(1)碘是合成下列哪种激素的主要原料之一( )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患( )
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为_______________________,氧化产物与还原产物的物质的量之比为____________,能观察到的明显现象是_______________________。
(4)已知KIO3可用电解方法制得。原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温度下电解KI溶液。总反应化学方程式为:KI+3H2O KIO3+3H2↑,
KIO3+3H2↑,
则两极反应式分别为阳极____________,阴极____________。
(5)在某温度下,若以12A的电流强度来电解KI溶液10min,理论上可得标况下氢气____________L。
解析 此题重点考查了一些卫生保健的常识及与其有关的化学知识。碘是合成甲状腺激素的主要原料之一,缺碘易患地方性甲状腺肿,这一病症可用食含碘食盐的方法来预防。这些内容属于卫生保健的常识性知识。但检验食盐中是否含碘及如何制取碘盐中所需的KIO3,则需用化学知识来解决。在酸性条件下,IO3-可氧化I-生成单质碘,碘遇淀粉变为蓝色,反应的化学方程式为:5KI+KIO3+6HCl=6KCl+3I2+3H2O,I2既是氧化产物,又是还原产物,其物质的量之比为5∶1。
电解KI溶液时,在阳极放电的是I-,电极方程式为I-+3H20-6e=IO3-+6H+,在阴极放电的是水电离出的H+,电极方程式为:6H2O+6e=3H2↑+6OH-。
本题的第(5)小题是利用电学知识解决化学问题。依据Q=It和1个电子的电量为1.60×10-19C,n(e)=![]() =7.475×10-2mol,V(H2)=
=7.475×10-2mol,V(H2)=![]() mol×22.4L/mol=0.837L
mol×22.4L/mol=0.837L
答案 (1)B (2)C(3)5KI+KIO3+6HCl=6KCl+3I2+3H2O 5∶l 溶液变蓝(4)阳极:I-+3H2O-6e=IO3-+6H+ 阴极:6H2O+6e=3H2↑+6OH- (5)0.837L
【能力突破训练】
一、选择题
1.1998年山西朔州发生假酒案,假酒中严重超标的有毒成份主要是( )
A.HCHO B.CH3OH C.CH3COOCH2CH3 D.CH3COOH
2.为证明在食盐中存在所加的“碘剂”,可用试纸和一些生活中常见的物质进行检验。在可供选用的物质:①自来水 ②蓝色石蕊试纸 ③碘化钾 ④淀粉 ⑤食盐 ⑥食醋 ⑦白酒,实验时必须使用③⑥,此检验中所发生的离子反应中阳离子的化学计量系数为( )
A.1 B.3 C.5 D.6
3.对苯二酚是一种常用的显影剂,据研究,它在水中电离出阴离子对已曝光的AgBr有显影作用,有关变化可表示为:
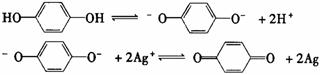
据此,在以对苯二酚为主要原料的D-72正性显影液中,能使显影速率显著加快的添加剂可用( )
A.溴化钾 B.磷酸二氢钠 C.碳酸钠 D.水
4.安全火柴盒侧面所涂物质是一种混合物,其中含有( )
A.白磷和Sb2S3等 B.红磷和Sb2S3等 C.KClO3、MnO2和S等 D.KNO3、MnO2和S等
5.在炼铁、制玻璃、制水泥生产中都需要的原料是( )
A.纯碱 B.石灰石 C.石英 D.粘土
6.吸烟者从烟中吸入的主要毒素,即尼古丁、致癌物烟焦油及( )
A.CO B.CO2 C.H2S D.氰化物
7.1838年3月纽卡斯尔市的一些园艺家来访问大物理学家法拉第,向它请教一个奇特而有趣的问题。别处生长的紫罗兰花都是紫色的,而生长在纽卡斯尔市的紫罗兰却是白色的。法拉第经过一番研究,得出结论,后来被化学家证实并在工业广泛应用。法拉第的结论是( )
A.遗传变异 B.纽卡斯尔市民用自来水浇花 C.纽卡斯尔空气中SO2的含量较高 D.施化肥不当
8.下列过程中,不涉及化学变化的是( )
A.甘油加水作护肤剂
B.用明矾净化水
C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味
D.烧菜用过的铁锅,经放置常出现红棕色斑迹
9.漂粉精的有效成分是( )
A.Ca(OH)2 B.Ca(ClO)2 C.CaCl2 D.CaCO3
10.人在做过剧烈运动后,有一段时间腿和胳膊感到有酸胀或疼痛的感觉。原因之一是C6H12O6(葡萄糖)![]() 2C3H6O3(乳酸)。乳酸4.5g跟足量的钠反应,在标况下得气体1120mL。
2C3H6O3(乳酸)。乳酸4.5g跟足量的钠反应,在标况下得气体1120mL。
9g乳酸与相同质量的甲醇反应,生成0.1mol乳酸甲酯和1.8g水,乳酸被氧化时得,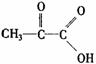 则乳酸的结构简式是( )
则乳酸的结构简式是( )
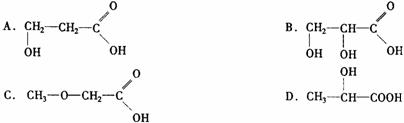
二、非选择题
11.利用天然气合成氨的工艺流程示意如下:
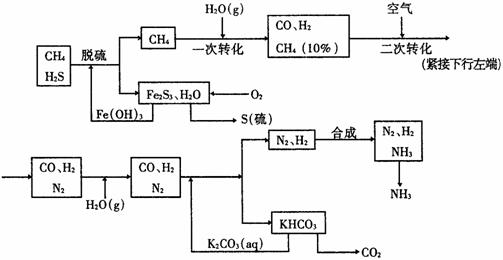
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________________。
(2)nmolCH4经一次转化后产生CO 0.09mol、产生H2____________mol(用含n的代数式表示)。
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是____________(多选扣分)。
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于_______________________(写出CO2的一种重要用途)。
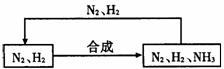
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
12.为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。为检验某种食盐是否为加碘盐,某同学取食盐样品428g,设法溶解出其中全部的碘酸钾,将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:IO3-+5I-+6H-→3I2+3H2O I2+2S2O32-→2I-+S4O62-
参考答案
【能力突破训练】
1.B 2.D 3.C 4.B 5.B 6.A 7.C 8.A 9.B 10.D
11.(1)3H2S+2Fe(OH)3![]() Fe2S3+6H2O (2)2.7n (3)b
Fe2S3+6H2O (2)2.7n (3)b
(4)生产纯碱[或作制冷剂等,其它合理答案也给分]
(5)
12.解:I2+2S2O32-![]() 2I-+S4O62-
2I-+S4O62-
![]() =0.03×18/1000×1/2=0.27×10-3(mol)
=0.03×18/1000×1/2=0.27×10-3(mol)
IO3-+5I-+6H+![]() 3I2+3H2O
3I2+3H2O
![]() =0.27×10-3×1/3=0.09×10-3(mol)
=0.27×10-3×1/3=0.09×10-3(mol)
每千克食盐中含KIO3:(214×0.09×10-3/428)×1000=45×10-3(g)=45(mg) ∴ 该加碘食盐是合格的

- 全部评论(0)
