物质结晶规律总结
时间:2016-01-15 15:32 来源:未知 作者:李久明 点击:次 所属专题: 结晶05
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一:蒸发浓缩--趁热过滤---洗涤--干燥
适用类型:溶解度随温度变化不大且溶解度相对较小的晶体
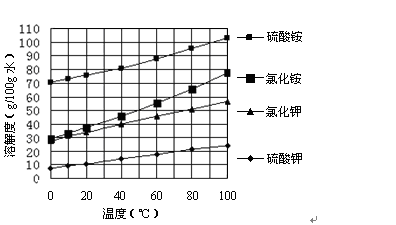
制备K2SO4:向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是蒸发浓缩(K2SO4在水中相对其他物质溶解度不大,由于水的蒸发使K2SO4晶体析出,需要蒸发至大量固体析出方可停止加热)、趁热过滤(趁热的目的防止其它物质如氯化钾、氯化铵、硫酸铵等杂质冷却结晶)、洗涤、干燥。
二:蒸发浓缩--冷却结晶--过滤--洗涤--干燥
适用类型一:溶解度随温度变化变化很大的晶体如KNO3晶体
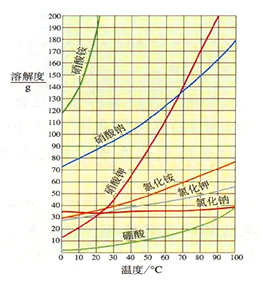
NaNO3和KCl溶液可以形成四种盐,在溶液中构成一个复杂的四元交互体系。利用四种盐在不同温度下溶解度的差异可制备KNO3晶体。下列是除去KNO3晶体中混有NaCl的过程:
工业上常采用转化法制备硝酸钾晶体,其反应如下:NaNO3+KCl ==NaCl+KNO3
阶段一
阶段二
对于重结晶,溶液中含有的杂质是少量的,此时用溶解度曲线进行分析,KNO3溶解度随温度变化很大,故可用下列实验程序:
硝酸钾粗品→配制热的浓溶液→冷却结晶→过滤→洗涤KNO3晶体(母液可适当循环)
适用类型二:带有结晶水的晶体如绿矾、胆矾晶体
首先用碱液除去废铁屑表面的油污,之后按如下步骤制备硫酸亚铁:
(1)在烧杯中倒入40mL 稀硫酸,加入足量废铁屑,以使稀硫酸浸没所有铁屑为度。小心加热(保持温度在50℃—80℃之间,不要煮沸),直到只有极少量气泡生成,同时溶液呈浅绿色为止(这时烧杯底部应留有少量铁屑)。
(2)用少量热水通过过滤器,以提高它的温度(防止溶液在漏斗里提前析出),然后将溶液趁热过滤。将滤液转入试管中,用橡皮塞塞住管口(防止空气进入),静置、(若需要进一步浓缩,只需加热到出现晶膜即停止加热),冷却、结晶,观察滤液冷却生长出浅绿色硫酸亚铁晶体的现象。
(3)待结晶完毕后,取出晶体,用少量水洗涤2—3次,再用滤纸将晶体吸干。
注:干燥的方法有自然风干、干燥器干燥、高温烘干等
(4)把制得的硫酸亚铁晶体放在一个小广口瓶中,密闭保存。
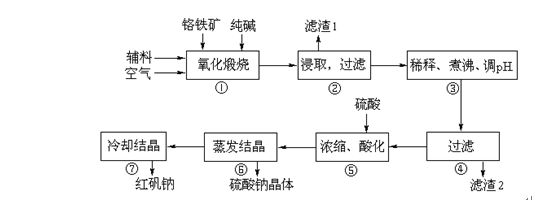
①中涉及的主要反应有:
主反应:4FeO·Cr2O3+8Na2CO3+7O2
副反应:SiO2+Na2CO3Na2SiO3+CO2↑、Al2O3+Na2CO32NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
完全沉淀时溶液pH | 4。7 | 3。7 | 11。2 | 5。6 |
试回答下列问题:
⑴ “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是
⑵ “③”中调节pH至4.7,目的是
⑶ “⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:
⑷ “⑦”中采用冷却结晶的方法析出红矾钠,依据是
(5).将6所得溶液
【答 案】⑴ 使反应物接触更充分,加快反应速率
⑶ 2CrO42-+2H+Cr2O72-+H2O

- 全部评论(0)
