盐溶液中的三大守恒
时间:2020-03-03 11:49 来源:未知 作者:王欣华 点击:次 所属专题: 三大守恒
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、三个守恒的建立
在盐溶液中,均存在两个物料守恒(即从水的电离和盐的电离两个角度,根据变化前后原子个数建立的守恒)和一个电荷守恒(即阴、阳离子所带的电荷总数相等)。那么这三个守恒是如何建立的呢?可分以下几种情况讨论:
1. 强酸强碱盐溶液
以![]() 溶液为例来说明。当我们把
溶液为例来说明。当我们把![]() 加入水中后,由于
加入水中后,由于![]() 所电离出的
所电离出的![]() 和
和![]() 不与
不与![]() 电离出来的
电离出来的![]() 和
和![]() 反应,因此有:
反应,因此有:
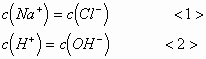
又因电解质溶液是电中性的,则有溶液中所有阳离子所带正电荷的总和等于溶液中所有阴离子所带负电荷的总和,当用浓度来表示电荷时则有:
![]()
2. 强酸弱碱盐溶液
以![]() 溶液为例。当我们把
溶液为例。当我们把![]() 加入水中以后,
加入水中以后,![]() ,
,![]() 。
。![]() 所电离出的
所电离出的![]() 会和
会和![]() 电离出的
电离出的![]() 发生反应生成弱电解质
发生反应生成弱电解质![]() ,即盐发生了水解,离子方程式为:
,即盐发生了水解,离子方程式为:![]()
这样![]() 溶液中的
溶液中的![]() 和
和![]() 的浓度就不再相等,而是
的浓度就不再相等,而是![]() ,由上面水解反应的离子方程式可看出,消耗
,由上面水解反应的离子方程式可看出,消耗![]() 的
的![]() 必生成1 mol
必生成1 mol ![]() ,因此可用生成的
,因此可用生成的![]() 的浓度来表示被消耗的
的浓度来表示被消耗的![]() 的浓度,则有:
的浓度,则有:
![]()
此时溶液中的![]() 和
和![]() 的浓度也不再相等,而是
的浓度也不再相等,而是![]() ,可以看出水电离出来的
,可以看出水电离出来的![]() 被
被![]() 消耗,且每消耗1 mol的
消耗,且每消耗1 mol的![]() 必生成1 mol
必生成1 mol ![]() ,因此可用生成的
,因此可用生成的![]() 的浓度来表示被消耗的
的浓度来表示被消耗的![]() 的浓度,则有:
的浓度,则有:
![]()
又因溶液是电中性的,于是有:
![]()
3. 强碱弱酸盐溶液
强碱弱酸盐溶液中这三个守恒的建立与强酸弱碱盐溶液中相似。以![]() 溶液为例,在
溶液为例,在![]() 溶液中,
溶液中,![]() 。
。![]() 发生水解即:
发生水解即:![]() ,使得溶液中的
,使得溶液中的![]() 。从上述反应方程式可以看出
。从上述反应方程式可以看出![]() 电离的
电离的![]() 一部分转化为
一部分转化为![]() ,一部分转化为
,一部分转化为![]() 。由碳原子守恒可知,每生成1 mol的
。由碳原子守恒可知,每生成1 mol的![]() 必消耗1 mol的
必消耗1 mol的![]() ,每生成1 mol的
,每生成1 mol的![]() 必消耗1 mol的
必消耗1 mol的![]() ,因此可用
,因此可用![]() 和
和![]() 浓度之和来表示消耗的
浓度之和来表示消耗的![]() 的浓度,则有:
的浓度,则有:
![]()
溶液显碱性,![]() 。水电离出来的
。水电离出来的![]() 被
被![]() 消耗,且每生成1 mol的
消耗,且每生成1 mol的![]() 必消耗1 mol的
必消耗1 mol的![]() ,而生成1 mol的
,而生成1 mol的![]() 将消耗2 mol的
将消耗2 mol的![]() ,因此可用
,因此可用![]() 和
和![]() 之和来表示消耗的
之和来表示消耗的![]() ,因此有:
,因此有:![]()
由溶液是电中性,有![]()
[注意上式中![]() 前面的2,因为1 mol的
前面的2,因为1 mol的![]() 所带电荷是2 mol]
所带电荷是2 mol]
综上所述,在盐溶液中都存在三个守恒,其中上述等式中的<1><4><7>是从盐的角度建立的物料守恒;<2><5><8>是从水的角度建立的物料守恒;<3><6><9>则是从电中性原理出发建立起的电荷守恒。下面我们看三个守恒在解题中的应用。
二、三个守恒在解题中的应用
例1. 等体积、等物质的量浓度的![]() 和
和![]() 溶液中,溶质离子总数相比( )
溶液中,溶质离子总数相比( )
A. 前者多 B. 后者多
C. 一样多 D. 无法判断
解析:溶质离子是指![]() 和
和![]() 。如果不考虑其他因素的影响,两者溶质离子总数相等。但由于
。如果不考虑其他因素的影响,两者溶质离子总数相等。但由于![]() 是强碱弱酸盐,在溶液中会发生水解,使得
是强碱弱酸盐,在溶液中会发生水解,使得![]() 数减少;而
数减少;而![]() 是强碱强酸盐,不发生水解,离子总数不变。两溶液中的
是强碱强酸盐,不发生水解,离子总数不变。两溶液中的![]() 数相等,而
数相等,而![]() 数小于
数小于![]() 数。因此,
数。因此,![]() 溶液中溶质离子总数大于
溶液中溶质离子总数大于![]() 溶液。
溶液。
答案:A
例2. 在0.1 mol/L的![]() 溶液中,含有多种分子和离子,下列关系式正确的是()
溶液中,含有多种分子和离子,下列关系式正确的是()
A. ![]()
B. ![]()
C. ![]()
D. 80℃时,![]()
解析:![]() 与
与![]() 都是强碱弱酸盐,分析方法相似。
都是强碱弱酸盐,分析方法相似。![]() 溶液中硫元素以
溶液中硫元素以![]() 三种形式存在,由S原子守恒可得:
三种形式存在,由S原子守恒可得:
![]() ,故A项正确;
,故A项正确;
由于![]() 溶液是电中性的,可得电荷守恒关系:
溶液是电中性的,可得电荷守恒关系:![]() ,故B正确;
,故B正确;
![]() 水解结合一个
水解结合一个![]() 生成
生成![]() 水解需结合2个
水解需结合2个![]() 生成
生成![]() ,由物料守恒得:
,由物料守恒得:![]() [一定要注意
[一定要注意![]() 前面的2],故C项不正确;
前面的2],故C项不正确;
水电离是吸热过程,80℃时水的电离程度比25℃时大,故80℃时![]() ,则D项不正确。
,则D项不正确。
答案:A、B

- 全部评论(0)
