探究相互竞争反应
时间:2012-09-28 20:24 来源:未知 作者:何永成 点击:次 所属专题: 反应先后
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
反应物间的化学反应常有“平行反应”和“竞争反应”两类,平行反应主要指多个反应相互间没有影响可同时进行;而竞争反应是指由于反应能力不同,多个反应按一定的先后顺序进行。
原创1
选项 | 反应体系 | 反应先后顺序判断 |
A | 含等物质的量的AlO、OH-、CO的溶液,逐滴加入盐酸 | AlO、OH-、CO |
B | 含等物质的量的FeBr2、FeI2的溶液,缓慢通入氯气 | I-、Br-、Fe2+ |
C | 含等物质的量的Ba(OH)2、KOH的溶液,缓慢通入CO2 | KOH、Ba(OH)2 |
D | 等物质的量的Fe3+、Ag+、Cu2+、H+的溶液,加入锌粉 | Ag+、Fe3+、Cu2+、 H+ |
【解析】 判断化学反应先后顺序的原则是先发生反应的产物与其他物质不再发生化学反应。A项,用假设法判断,若H+最先与AlO反应,生成氢氧化铝,而氢氧化铝与溶液中的OH-反应生成AlO,故A错。B项,氯气依次氧化I-、Fe2+、Br-,因为2Fe2++Br2===2Fe3++2Br-,故B错。C项,氢氧化钡先发生反应,因为碳酸钾与氢氧化钡不能共存,故C错。D项,氧化性顺序:Ag+>Fe3+>Cu2+>H+,D正确。答案:D
【原创探究】 竞争反应主要包括两种基本题型:一是一种氧化剂(还原剂)与多种还原剂(氧化剂)反应,如把Cl2通入含I-、Br-、Fe2+的溶液中,按照还原能力由强到弱的顺序, I-优先反应,其次是Fe2+,最后是Br-;二是一种酸(碱)与多种碱性(酸性)物质反应,如把盐酸逐滴加入含有NaOH、Na2CO3、NaHCO3的混合溶液中,按照碱性由强到弱的顺序,NaOH优先反应,其次是Na2CO3,最后是NaHCO3。在实际问题中有部分看似是平行反应,由于物质的性质而出现了“有效”和“无效”两种可能性,准确确定有效反应就成了解题的关键。
原创2
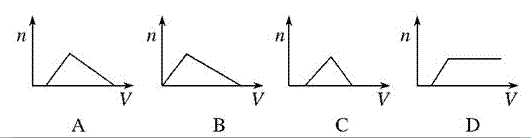
【解析】NH3通入硝酸和硝酸银的混合溶液中,先与硝酸反应,故开始没有沉淀,等硝酸全部反应完全后,再与硝酸银反应生成氢氧化银沉淀,再继续通入氨气会生成可溶性的银氨溶液,故沉淀又会减少,直至最终没有沉淀,反应方程式为NH3+HNO3===NH4NO3、NH3+AgNO3+H2O===AgOH↓+NH4NO3、AgOH+2NH3===
【方法技巧】若某一溶液中同时存在几个可能的反应,则生成更难溶或更难电离物质的反应将优先进行。
变式二
原创3
A.还原性:I─>Fe2+>Br─
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中发生的离子反应可表示为 2Fe2++2I─+2Cl2===2Fe3++I2+4Cl─
D.原溶液中:n(Fe2+)︰n(I─)︰n(Br─)=2︰1︰3
【解析】解本题的关键是要弄清楚氯气与I─、Fe2+、Br─之间发生的氧化还原反应,结合题目所给反应与氧化还原反应的规律知,还原性:I─>Fe2+>Br─,A项正确;通入Cl2后,被氧化的先后顺序为I─、Fe2+、Br─,Fe2+在通入氯气量从1 mol~3 mol的过程中从最大量逐渐下降至0,即得n(I─)=2 mol,n(Fe2+)=4 mol,据电中性原理知,n(Br─)=6 mol,即n(FeBr 2)=3 mol,B项错误、D项正确;当通入2 mol Cl2时,2 mol I─消耗1 mol Cl2,余下的1 mol Cl2再与2 molFe2+反应,C项正确。答案:B
【方法技巧】 若某一溶液中同时含有多种还原性(氧化性)物质,则加入一种氧化剂(还原剂)时,优先氧化还原性(氧化性)强的物质。
变式三
原创4
| 已知 | 类推 |
A | Fe(OH)3溶于盐酸:Fe(OH)3+3H+=== Fe3++3H2O | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应:2Fe+3Cl22FeCl3 | 铁和碘单质反应2Fe+3I22FeI3 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
【解析】Fe(OH)3与氢碘酸会发生氧化还原反应, A错;NaHSO4溶于水电离出Na+、H+和SO,与Ba(OH)2溶液反应至中性时的离子方程式为2H++SO+Ba2++2OH-===BaSO4↓+2H2O,B对;碘的氧化性较弱,与铁反应时生成FeI2,C错;向Ca(ClO)2溶液中通入二氧化硫后,由于次氯酸盐和次氯酸都具有强氧化性,而亚硫酸盐和二氧化硫都具有还原性,所以是发生氧化还原反应而不是发生复分解反应。答案:B
【方法技巧】氧化还原反应与非氧化还原反应之间的竞争,一般情况下,氧化还原反应比非氧化还原反应先发生。

- 全部评论(0)
