化学反应中的先后规律小结
时间:2022-08-11 16:20 来源:未知 作者:陈艳丽 点击:次 所属专题: 反应先后 化学反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
关于一种物质与多种物质发生化学反应时,一定要确定反应的先后顺序,否则,各反应混乱,必然影响答题。反应先后顺序的一般规律是符合强强组合、强者优先反应;先发生反应的产物必须与其他物质大量共存。
一、氧化还原反应先后规律
1.还原性强的物质优先反应:
在浓度相差不大的溶液中,同时含有几种还原剂时,若加入一种氧化剂,首先与溶液中最强的还原剂反应。
例1.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为________。
解析:混合溶液中各种离子(还原剂)的还原性强弱顺序为:I-﹥Fe2+﹥Br-﹥Cl-,通入氧化剂Cl2后,溶液中还原性强者先反应,先后顺序为:Cl2+2I-==I2+2Cl-,2Fe2++Cl2==2Fe3++2Cl-,Cl2+2Br-==Br2+2Cl-。如果考虑Cl2先与Br-反应,生成的Br2与I-、Fe2+不能大量共存,Br2又会被I-、Fe2+离子还原生成Br-,故反应顺序符合强者优先原则。题设溶液中有Fe2+剩余,则Br-未反应,I-完全反应。设原混合溶液中Cl-、Br-、I-的物质的量分别为2 mol、3 mol、4 mol,根据电荷守恒,知原溶液中Fe2+的物质的量为(2 mol+3 mol+4 mol)/2=4.5 mol,反应后溶液中Cl-的物质的量为3×3 mol=9 mol,根据Cl元素守恒,知通入的Cl2的物质的量为(9mol-2 mol)/2=3.5 mol,与I-完全反应的Cl2的物质的量为2mol,则与Fe2+反应的Cl2的物质的量为1.5mol,被反应的Fe2+的物质的量为3mol,剩余的Fe2+的物质的量为1.5 mol,故通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为3.5 mol∶1.5 mol=7∶3。
2.氧化性强的物质优先反应:
在浓度相差不大的溶液中,同时含有几种氧化剂时,若一种加入还原剂,首先与溶液中最强的氧化剂反应。
例2.含有硝酸锌、硝酸铁、硝酸镁、硝酸铜、硝酸银五种溶质的溶液中加入一定量的铁粉,充分反应后过滤,滤纸上一定有________,可能有________;滤液中一定有________,可能有________;如果滤纸上有铁,则滤纸上一定同时有________,滤液中一定没有________。
解析:溶液中五种金属阳离子(氧化剂)的氧化性强弱顺序为:Ag+﹥Fe3+﹥Cu2+﹥Zn2+﹥Mg2+,加入还原剂Fe粉后,,溶液中氧化性强者先反应,先后顺序为:Fe+2Ag+==Fe2++2Ag,Fe+2Fe3+
此外,有关电化学中的原电池反应或电解反应均是氧化还原反应原理的应用,因此,金属参与反应或被腐蚀的先后顺序、金属阳离子或阴离子的放电顺序均符合氧化性或还原性强者优先的原则。如铁铜合金放在潮湿空气中的腐蚀,铁先发生电化学反应依次生成Fe2+和Fe(OH)2,Fe(OH)2再被氧气氧化生成Fe(OH)3并形成铁锈(Fe2O3·N H2O);铜后发生腐蚀生成铜锈[Cu2(OH)2CO3]。
二、离子反应先后规律
1.碱性强的离子优先反应:
在浓度相差不大的溶液中,同时含有几种电离或水解呈碱性的离子时,若加入一种酸或一种呈酸性的物质,首先与溶液中碱性最强的离子反应。
例1.在CH3COONa、Na2CO3、NaOH、Na2SiO3的混合溶液中,逐滴加入盐酸使之完全反应,请依次写出各步离子方程式。
解析:Na2SiO3、Na2CO3、CH3COONa相应的酸强弱顺序为:CH3COOH﹥﹥H2CO3﹥H2SiO3,越弱的酸相应的酸根离子水解碱性越强,因此,溶液中四种溶质的碱性强弱顺序为:NaOH﹥Na2SiO3﹥Na2CO3﹥CH3COONa。如果先考虑盐酸先与CH3COONa反应,生成的CH3COOH与OH-、SiO32-、CO32-等均不能大量共存,CH3COOH又会被这些离子反应生成CH3COO-,故离子反应要符合强者优先原则,其先后反应依次为:
①H++OH-== H2O,
②2H++SiO32-== H2SiO3↓,
③H++CO32-== HCO3-,H++HCO3-==CO2↑+H2O,
④H++CH3COO-== CH3COOH。
此外,向混有Cu(OH)2沉淀的NaOH溶液中滴入稀硫酸、向混有CaCO3沉淀的Na2CO3溶液滴入稀盐酸、将CO2不断通入KOH、Ba(OH)2、K[A1(OH)4]的混合溶液中等均属于类似情况。
2.酸性强的离子优先反应:
在浓度相差不大的溶液中,同时含有几种电离或水解呈酸性的离子时,若加入一种碱或一种呈碱性的物质,首先与溶液中酸性最强的离子反应。
例2.在NH4+、Al3+、H+、Mg2+的混合溶液中,逐滴加入烧碱溶液至过量,请依次写出各步离子方程式。
解析:NH4+、Al3+、Mg2+水解程度大小顺序为:Al3+﹥Mg2+﹥NH4+,因此,溶液中四种离子的酸性强弱顺序为:H+﹥Al3+﹥Mg2+﹥NH4+。如果先考虑烧碱溶液先与NH4+反应,生成的NH3·H2O与H+、Al3+、Mg2+等均不能大量共存,NH3·H2O又会被这些离子反应生成NH4+,故离子反应要符合强者优先原则,其先后顺序为:
①OH-+H+== H2O,
②3OH-+Al3+== Al(OH)3↓,
③2OH-+Mg2+== Mg(OH)2↓,
④OH-+NH4+== NH3·H2O,
⑤Al(OH)3+OH-==[Al(OH)4]-
此外,向CaCl2和HCl的混合溶液中滴入Na2CO3溶液、把CO2和HCl的混合气体通入强碱溶液中、NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液、NH4HCO3与NaOH反应等均属于类似情况。
3.溶度积小者优先反应:
在浓度相差不大的溶液中,同时含有几种可被某种沉淀剂沉淀的离子时,若加入一种沉淀剂,首先与溶液中难溶物溶度积最小的离子发生沉淀反应。
例3.在含有Cl-、Br-、I-、S2-离子的混合溶液中,逐滴加入硝酸银溶液,请依次写出各步离子方程式。
解析:各种银盐的Ksp大小顺序为:AgCl﹥AgBr﹥AgI﹥Ag2S。如果硝酸银溶液先与Cl-反应,生成AgCl沉淀与Br-、I-、S2-离子不能大量共存,可发生沉淀转化,2AgCl(s)+S2-(aq)===Ag2S(s)+ Cl-(aq),AgCl沉淀又转化为Cl-。因此,沉淀反应要符合难溶物溶度积最小的离子先发生的规则,即四种离子生成沉淀的离子反应依次为:①S2-+2Ag+==Ag2S↓,②I-+Ag+==AgI ↓,③Br-+Ag+==AgBr↓,④Cl-+Ag+==AgCl↓。
此外,向Na2CO3与Na2SO4混合溶液中逐滴加入BaCl2溶液,向硝酸锌、硝酸亚铁、硝酸铜的混合溶液中逐滴加入Na2S溶液等均属于类似情况。
三、其他反应先后规律
除了上述氧化还原反应和离子反应有先后顺序外,一些普通反应也有先后顺序。如:Na2O2粉末与过量NaHCO3于密闭容器中高温加热,充分反应后排出生成气体,则剩余的固体为________。
过量的NaHCO3先发生分解反应,生成的CO2和H2O均与Na2O2粉末反应,CO2酸性强优先反应,H2O后反应;因为CO2过量,H2O没机会反应,故剩余的固体只能是Na2CO3。如果是Na2O2粉末过量,NaHCO3分解生成的CO2和H2O全部反应,则剩余的固体是Na2CO3和NaOH。
近三年来各地高考试题考查到反应先后顺序的考点,主要是离子反应和氧化还原反应的先后问题。部分题目整理如下供参考。
1.(09全国卷Ⅱ13)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是(
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
答案:B
2.(09宁夏卷12)能正确表示下列反应的离子方程式是(
A.向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
答案:D
3.(2010上海卷11)将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是(
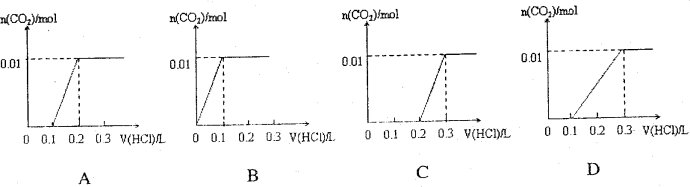
答案:C
4.(2010四川理综卷9)下列离子方程式书写正确的是(
A.向明矾溶液中加入过量的氢氧化钡溶液:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
C.向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3·H2O
D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
CH2BrCOOH+ OH- CH2BrCOO-+H2O
CH2BrCOO-+H2O
答案:A
5.(2011上海卷21)在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是(
A.Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH4++Fe3++2SO42-+2Ba2++4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH4++Fe3++3SO42-+3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
答案:BC

- 全部评论(0)
