在学习元素化合物知识时,常将非金属或金属元素及其化合物单独分开归类进行学习。这里试图打破常规,跳出自然族的框架,另避蹊径,将同周期的铝、硅元素作为“孪生兄弟”进行对比学习,寻求共性。
一、理论依据
根据元素周期表知识可知:位于第三周期的铝、硅是隔壁邻居,且均处于金属和非金属的分界线附近,同桌的你,是同学,是兄弟,是双胞胎。铝、硅元素的体征相
貌虽然各异,一是金属,一是非金属;一是典型的非金属材料,一是重要的金属材料;但性格十分相似,既表现某些金属性质,又表现某些非金属性质。不信你可以
现场考察:铝、硅元素及其化合物有着许多共性之处。
二、共性表现
1.铝、硅的脾气相投,都喜欢广交氧化剂为朋友,均表现还原性。
①在氧气中加热后均能燃烧,同时放出大量热。
2Al+3O2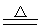 2Al2O3 Si+O2
2Al2O3 Si+O2 SiO2
SiO2
②与许多非金属单质发生反应(如卤素、氮气、碳等)。
2Al+3F2==2AlF3 Si+2F2==SiF4
2Al+3Cl2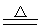 2AlCl3 Si+2Cl2
2AlCl3 Si+2Cl2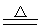 SiCl4
SiCl4
2Al+N2 2AlN 3Si+2N2
2AlN 3Si+2N2 Si3N4
Si3N4
4Al+3C  Al4C3 Si+C
Al4C3 Si+C
 SiC
SiC
③与强碱溶液反应,其单质失去的电子均由水中氢离子获得,故注明电子转移方向和数目时,应在化学方程式两边加上一定数目的水分子。
6e-

2Al+2OH-+6H2O==2AlO2-+3H2↑+4H2O
或2Al+2OH-+6H2O==2[Al(OH)4]-+3H2↑
4e-

Si+2OH-+4H2O
==SiO32-+2H2↑+3H2O
④与某些金属氧化物反应:
2Al+3FeO Al2O3+3Fe Si+2FeO
Al2O3+3Fe Si+2FeO SiO2+2Fe
SiO2+2Fe
⑤与某些强氧化性酸反应:
Al+6HNO3(浓)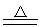 Al(NO3)3+3NO2↑+3H2O
Al(NO3)3+3NO2↑+3H2O
Si+4HNO3(浓)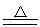 SiO2+4NO2↑+2H2O
SiO2+4NO2↑+2H2O
⑥还原适量的氢氟酸:
2Al+6HF==2AlF3+3H2↑ Si+4HF==SiF4↑+2H2↑
2.氧化铝、二氧化硅体貌相同,都属于氧化物的身份,均表现酸酐通性。
①两兄弟均不溶于水,均是高熔点、高硬度的氧化物,均可作耐火材料;均可在高岭土(主要成分:Al2O3•2SiO2•2H2O)、正长石(主要成分:K2O•Al2O3•6SiO2)、钠长石(主要成分:Na2O•Al2O3•6SiO2)等矿石中共生;水泥主要成分中均含有两兄弟:硅酸三钙(3CaO•SiO2)、硅酸二钙(2CaO•SiO2)、铝酸三钙(3CaO•Al2O3);均为两种酸的酸酐,Al2O3虽属两性氧化物,但他是H3AlO3或HAlO2的酸酐,即铝酸酐或偏铝酸酐,SiO2是H4SiO4或H2SiO3的酸酐,即原硅酸酐或硅酸酐。
②与强碱溶液反应:
Al2O3+2OH-==2AlO2-+H2O或Al2O3+2OH-+3H2O==2[Al(OH)4]-
SiO2+2OH-==
SiO32-+H2O
③与某些碱性氧化物反应:
Al2O3+CaO Ca(AlO2)2 SiO2+CaO
Ca(AlO2)2 SiO2+CaO CaSiO3
CaSiO3
④与某些盐反应:
Al2O3+Na2CO3 2NaAlO2+CO2↑
SiO2+Na2CO3
2NaAlO2+CO2↑
SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤与适量氢氟酸反应:
Al2O3+6HF==2AlF3+3H2O SiO2+4HF==SiF4↑+2H2O
3.氢氧化铝、硅酸性格相似,都是既喜欢结交异性又不太稳重,均表现出不溶性酸的性质。
①与强碱溶液反应:
Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-
H2SiO3+2OH-==SiO32-+2H2O
②受热均可分解,显示出不稳定性:
2Al(OH)3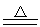 Al2O3+3H2O H2SiO3
Al2O3+3H2O H2SiO3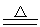 SiO2+H2O
SiO2+H2O
4.可溶性的偏铝酸盐与硅酸盐面目相同,都会在水中显出自己的勇敢行为,均表现弱酸盐的性质。
①水解均显碱性:
AlO2-+2H2O Al(OH)3+OH- SiO32-+2H2O
Al(OH)3+OH- SiO32-+2H2O H2SiO3+2OH-
H2SiO3+2OH-
②与适量强酸或通入过量CO2以及加入酸性强于偏铝酸与硅酸的酸,均生成白色胶状沉淀。
AlO2-+H++H2O==Al(OH)3↓或[Al(OH)4]-+H+==Al(OH)3↓+H2O
SiO32-+2H++H2O==H4SiO4↓或SiO32-+2H+==H2SiO3↓
AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-
或
[Al(OH)4]-+CO2==Al(OH)3↓+HCO3-
SiO32-+2CO2+2H2O==H4SiO4↓+2HCO3-
或SiO32-+2CO2+H2O==H2SiO3↓+2HCO3-
③与水解呈酸性的盐(如氯化铵、氯化铁等)均发生互相促进水解反应:
AlO2-+NH4++H2O==Al(OH)3↓+NH3↑
或[Al(OH)4]-+NH4+==Al(OH)3↓+NH3↑+H2O
SiO32-+2NH4++H2O==H4SiO4↓+2NH3↑
或SiO32-+2NH4+==H2SiO3↓+2NH3↑
5.氯化铝与四氯化硅、氮化铝与氮化硅模样相仿,都酷爱水姑娘,与水均发生能强烈水解。
①氯化铝、四氯化硅与水均发生能强烈水解并产生大量白雾。
AlCl3+3H2O==Al(OH)3↓+3HCl↑ SiCl4+3H2O==H2SiO3↓+4HCl↑
②氮化铝陶瓷、氮化硅陶瓷均有较高的硬度和耐磨性、较强的抗化学侵蚀性和电绝缘性、耐高温等良好性能。但粉末状的氮化铝与氮化硅在水中均不稳定,均可发生水解反应。
AlN+3H2O==Al(OH)3↓+NH3↑ Si3N4+9H2O==3H2SiO3↓+4NH3↑
三、结束语
在学习铝元素的两性时,硅元素的性质可迁移学习,既有利于突破铝元素两性这一重难点知识,又有利于巩固与碳元素有别的硅元素性质。真可谓“孪生兄弟”相得益彰。
![]() 2Al2O3
2Al2O3 ![]() SiO2
SiO2![]() 2AlCl3
2AlCl3 ![]() SiCl4
SiCl4 2AlN
2AlN  Si3N4
Si3N4 Al4C3
Al4C3  SiC
SiC

 Al2O3+3Fe
Al2O3+3Fe  SiO2+2Fe
SiO2+2Fe Al(NO3)3+3NO2↑+3H2O
Al(NO3)3+3NO2↑+3H2O SiO2+4NO2↑+2H2O
SiO2+4NO2↑+2H2O Ca(AlO2)2
Ca(AlO2)2  CaSiO3
CaSiO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
 Na2SiO3+CO2↑
Na2SiO3+CO2↑ Al2O3+3H2O
Al2O3+3H2O  SiO2+H2O
SiO2+H2O Al(OH)3+OH-
Al(OH)3+OH-  H2SiO3+2OH-
H2SiO3+2OH-
